 |
Intelligente Konstruktion für eine optimierte Nachtsicht
von Henrik Ullrich
Studium Integrale Journal
17. Jahrgang / Heft 1 - Mai 2010
Seite 29 - 32
|
 |
Zusammenfassung: Das Wirbeltierauge überrascht die Wissenschaftler immer wieder. Auf allen Ebenen – zellbiologisch, histologisch, anatomisch – gilt: Wenn man die Zusammenhänge vom Aufbau und der Funktion des Auges erschließt, stellt sich heraus, dass alle Merkmale der Optimierung des Sehens in den verschiedensten Lebensumwelten der Organismen dienen. Dies bestätigt eindrucksvoll ein neu entdeckter Zusammenhang zwischen der Binnenstruktur von Zellkernen in den Sinneszellen der Netzhaut und dem tag- und nachtaktiven Verhalten bei Säugetieren. Einmal mehr zeigt sich: Der Behauptung, das Auge sei eine fehlerhafte evolutionäre Kompromisslösung, fehlt jegliche empirische Basis.
|  |
|
Einführung
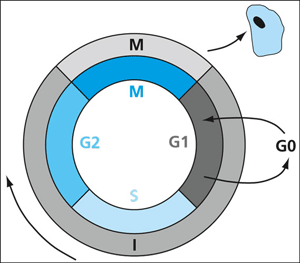 |
| Abb. 1: Zellzyklus. Vermehrungsfähige Zellen durchlaufen einen durch Steuerungsproteine geregelten Zyklus. Die Phasen G1, S, G2 bilden die Intermediärphase oder Intermitosephase, in welcher die Zelle auf ihre Teilung (Phase M) vorbereitet wird. Zellen, die ihrer spezifischen Funktion nachkommen (wie Stäbchenzellen: Reizaufnahme), proliferieren nicht und befinden sich in der G0-Phase. (GNU Freie Dokumentationslizenz) |
|
Das Auge sorgt immer wieder für Überraschungen, welcher Organismus dabei auch immer im Focus des Interesse steht. Die Leistungsspektren von Wirbeltieraugen, von Linsenaugen bei Tintenfischen oder der Komplexaugen bei den Insekten stellen sich aus ingenieurtechnischer Perspektive als perfekt und exakt abgestimmte Kombinationen von Einzelelementen (z. B. Hornhaut, Linse, Glaskörper, Regenbogenhaut, Netzhaut) dar, die sich im Verlauf der Embryonalentwicklung auf atemberaubende Weise zusammenfügen.
Die funktional-analytisch arbeitende Biologie machte wiederholt Entdeckungen, die sich für ein evolutionsbiologisches Verständnis der Entstehung und Entwicklung der Sehorgane als äußerst problematisch erwiesen. So widerlegte kürzlich die Entdeckung von Nervenfortsätzen, die als Lichtleitkabel funktionieren, die Behauptung, die Netzhaut von Wirbeltieraugen sei evolutionär bedingt eine – wenn auch kompensierte – Fehlkonstruktion (vgl. Ullrich 2008).
Kürzlich berichteten Solovei und ihr Team in der Fachzeitschrift „Cell“ (2009) von einem bislang unbekannten architektonischen Arrangement im Zellkern von Rezeptorzellen, das nachtsichtigen Säugetieren (z. B. Mäusen) eine verbesserte Ausnutzung des Lichtes in der Dunkelheit möglich macht. Aus evolutionsbiologischer Perspektive sind die neuen Erkenntnisse unerwartet und erschweren erneut eine plausible hypothetische Rekonstruktion der Entwicklung von Augen bei Säugetieren.
|
Transkription: Bei der Transkription wird im Zellkern ein DNA-Abschnitt abgelesen und als RNA-Molekül vervielfältigt, das heißt ein spezifischer DNA-Abschnitt dient als Vorlage zur Synthese eines neuen RNA-Strangs. Stäbchenzellen und Zapfenzellen: Spezialisierte Sinneszellen der Netzhaut. Stäbchenzellen dienen vor allem dem Hell-Dunkel-Sehen, Zapfenzellen ermöglichen das Farbsehen. Ontogenetische Differenzierung: Während der Individualentwicklung aufeinander folgende abgestimmte Entwicklungsschritte auf zellulärer, organischer und organismischer Ebene, in deren Ergebnis morphologisch und funktionell reife Zellen, Gewebe und Organe entstehen.
|
|
|
Verteilung von Chromatin im Zellkern
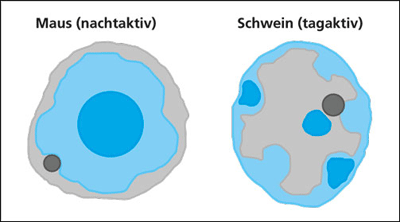 |
| Abb. 2: Verteilung der Chromatinanteile (Heterochromatin und Euchromatin) während der stationären Interphase in Stäbchenzellen bei nacht- und tagaktiven Tieren. Das kompaktere Heterochromatin mit höherem Brechungsindex ist blau/hellblau, das weniger kompakte Euchromatin hellgrau und der Nucleus dunkelgrau dargestellt. Nach Solovei et al. (2009) |
|
Die im Zellkern gelegene Erbinformation, die DNA, ist in der Interphase (vgl. Abb. 1) spiralförmig um einzelne Eiweißkomplexe (Histone) gewickelt, welche aneinandergereiht wie die Glieder einer Kette eine optimale und hoch komprimierte Verpackung des Erbguts erlauben. Dieser Komplex aus Proteinen und DNA heißt Chromatin. An den Stellen, wo jedoch aus funktionellen Gründen ein Ablesen des Erbmaterials (z. B. Transkription in der G1-Phase des Zellzyklus) erforderlich ist, wird das Chromatingerüst aufgelockert, damit die speziellen Enzymkomplexe aktiv werden können. Das eng gepackte Chromatin nennt man in der Fachsprache das Heterochromatin, das aufgelockerte ist das Euchromatin. Es galt bisher als ein universelles Prinzip der Zellkernarchitektur, so Solovei und Mitarbeiter, dass bei allen höheren Organismen (Vielzeller, Metazoa) während der Interphase das Euchromatin im Inneren des Zellkerns und das Heterochromatin im äußeren Bereich des Zellkerns gelegen ist (Abb. 2). Abweichungen von diesem konventionellen Bauplan sind nur bei wenigen Einzellern (z. B. Dinoflagellata, Wimperntierchen) und bei einigen Hefearten bekannt. Forscher nehmen an, dass die konventionelle Kernarchitektur mit ihrer räumlichen Anordnung des Chromatins Ausdruck einer wichtigen Funktion zur Regelung der Transkription* ist und deshalb so universal Verbreitung fand.
|
|
Die Überraschung – Stäbchenzellen tanzen aus der Reihe
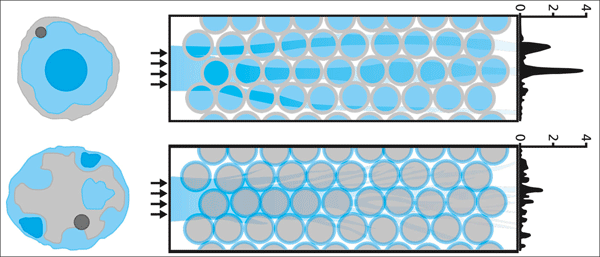 |
| Abb. 3: Schema der Bündelung von Licht durch Heterochromatin. Die invertierten Kerne (oben rechts) wirken wie Mikrolinsen, die das Licht fokussiert zu den darunter liegenden lichtempfindlichen Teilen der Stäbchen leiten. Konventionelle Kerne streuen das Licht dagegen (unten rechts). Nach Solovei et. al. (2009), Farbkodierung wie in Abb. 2. |
|
Stäbchenzellen* und Zapfenzellen* sind mittels einer kaskadenartigen Kopplung von unterschiedlichen Proteinkomplexen (u.a. Rhodopsin) in der Lage, Lichtquanten in elektrische Signale umzuwandeln, die dann über die Nervenzellfortsätze weitergeleitet und in verschiedenen Zentren des zentralen Nervensystem zu Bildinformationen verarbeitet werden (Ullrich et al. 2006). Die Stäbchenzellen nachtsichtiger Tiere stellen nun, so die erste interessante Entdeckung, die konventionelle Zellkernarchitektur des Chromatins auf den Kopf. Da Stäbchenzellen bei entwickelten Tieren am Ende ihres Differenzierungswegs nicht mehr teilungsfähig sind, durchlaufen sie keinen Zellzyklus und verbleiben in der Interphase. Die dicht gepackten Anteile des Chromatins (Heterochromatin) befinden sich bei Stäbchenzellen – entgegen der Regel – im Zentrum des Zellkerns. Die weniger dicht gepackten, funktionell aktiven Anteile (Euchromatin) lagern zusammen mit Genkopien (mRNA), dem Kernkörperchen und den enzymatischen Werkzeugen in der Peripherie. Diese auf den Kopf gestellte Architektur – und das ist die zweite Überraschung – ist funktionell äußerst sinnvoll.
Die unterschiedlichen optischen Eigenschaften (Brechungsindex) der Chromatinkomponenten liefern eine physiologische Erklärung für deren ungewöhnliche Anordnung in den Stäbchen, welche experimentell bestätigt werden konnte. Heterochromatin besitzt einen höheren Brechungsindex als Euchromatin. Die Zellkerne der Photorezeptorzellen haben einen relativ großen Durchmesser im Vergleich zu ihren langen dünnen Zellkörpern (Segmente), in denen die eigentliche Absorption des Lichts erfolgt. Die Zellkerne sind in mehreren Lagen vor den Segmenten in einer hexagonalen Anordnung palisadenartig „aufgestapelt“ (entspricht äußeren Körnerschicht des Netzhaut) und werden durch eine dünne Verbindung mit ihrem jeweiligem Segment verbunden. Statt das (über die Fortsätze der Müllerzellen) eintreffende Licht zu zerstreuen, wirken die dicht gepackten Zellkerne wie kleine fokussierende Mikrolinsen. Diese bündeln die wenigen Lichtquanten und führen sie ohne Streuverluste zu den o.g. Proteinkomplexen in den lichtempfindlichen Außensegmenten der Fotorezeptoren (siehe Abb. 3).
|
|
Evolutionsbiologische Fragen und Erklärungsversuche
 |
Die Existenz der invertierten Kern-
architektur in Stäbchenzellen ist ein
Beleg für die perfekte Konstruktion der
invertierten Netzhaut bei Wirbeltieren. |
 |
|
So unerwartet – aber auch sinnvoll – die hier beschriebene und entgegen dem universellen Prinzip sich darstellende Zellkernarchitektur ist, so unklar ist es, einen kausalen Mechanismus anzugeben, der im Verlauf der Evolution von Säugetieren diese fundamentale Abwandlung hätte bewirken können. Die Herausforderung besteht zunächst darin, eine für das Makrosystem Auge wichtige Funktion (optimale Nutzung angebotener Lichtquanten in der Dunkelheit) durch eine räumliche Neukonfiguration von Zellkernbausteinen möglich zu machen, ohne dabei die physiologischen Grundfunktionen des Zellkerns (z. B. Transkription während der Interphase) zu beeinträchtigen. Zweitens, die umgekehrte Architektur tritt sekundär im Verlauf der ontogenetischen Differenzierung* der Stäbchenzellen und nur bei diesen auf (s. u.). Das bedeutet: Der evolutionäre Wandel muss so fein abgestimmt sein, dass das Ergebnis in der richtigen ontogenetischen Zelldifferenzierungsphase und nur bei einem bestimmten Zelltyp (Stäbchenzellen) auftritt. Bei der Maus beginnt die Vermehrung (Proliferation) der Stäbchenzellen am 5. Tag nach der Geburt, ausgehend vom Zentrum der Retina. Die Stäbchenkerne zeigen hier noch die konventionelle Architektur. Am 13. Tag öffnen sich die Augen der Maus, am 21. beginnen die Architekturveränderungen. Am 28. Tag ist die Umorientierung des Chromatins bei nahezu allen Stäbchenzellen erfolgt (terminale Differenzierung), der höchste Grad der Konzentration des Heterochromatins im Zentrum (Verschmelzen einzelner Chromatininseln zu einem Komplex) des Zellkerns ist bei 9 Monate alten Mäusen erreicht.
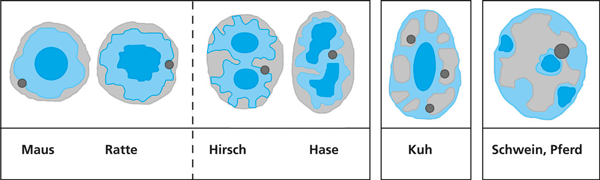 |
| Abb. 4: Schematische Darstellung der invertierten, invertiert-intermediären und konventionellen Architektur des Zellkerns bei verschiedenen Tierarten. Nach Solovei et al. (2009), Farbkodierung wie in Abb. 2. |
|
Zusätzlich ist zu berücksichtigen, dass sich Stäbchen- und Zapfenzellen ontogenetisch von undifferenzierten neuronalen Stammzellen ableiten. Erst im Wechselspiel mit räumlich und zeitlich wirksamen Entwicklungsfaktoren erlangen sie ihre endgültige funktionelle und morphologische Spezialisierung (also ihre umgedrehte Architektur). Das bedeutet, auch das intra- und extrazelluläre Umfeld der Stäbchenzellen muss passend durch die evolutionären Mechanismen mit verändert werden, und zwar so, dass die Funktionalität des Gesamtsystems Auge in keiner Phase verloren geht bzw. beeinträchtigt wird.
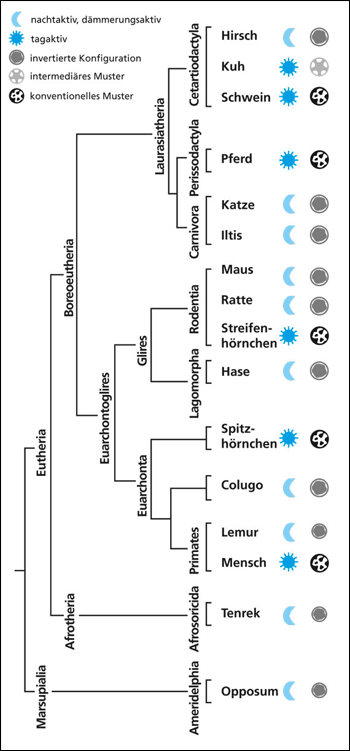 |
| Abb. 5: Verteilung des Merkmals der invertierten, intermediären und konventionellen Kernarchitektur im Stammbaum der Säugetiere nach Solovei et al. (2009). Eine mehrfache unabhängige konvergente bzw. parallele Entstehung und Rückbildung muss aus evolutionstheoretischer Sicht postuliert werden. |
|
|
Drittens lieferten weitere vergleichende zellbiologische Untersuchungen bei unterschiedlichen Säugetieren Ergebnisse, die nach bisherigen evolutionstheoretischen Modellierungen nicht erwartet wurden. „Unsere Daten offenbarten eine völlig unerwartete, jedoch sehr klare Korrelation zwischen der Zellkernarchitektur der Stäbchenzellen und der Lebensweise“, stellen Solovei et al. (2009, 360) fest. Die Wissenschaftler analysierten weitere 16 landlebende Säugetierarten aus unterschiedlichen Säugetierfamilien. In jeder Ordnung fanden sich Arten mit und ohne eine Umorientierung des Chromatins in strenger Korrelation zu ihrer Lebensweise als nacht- oder tagaktive Tiere. Es fanden sich keine signifikanten Unterschiede in den Details der invertierten Zellkernmorphologie bei den jeweiligen Arten unterschiedlicher Familien. Die Ergebnisse wurden bestätigt durch die Einbindung weiterer Daten anderer Forscher von 22 Arten. Bei einigen dämmerungsaktiven Tieren (z. B. Hirsch, Katze, Hase, Frettchen, Lemur, Opossum) und bei Kühen beschreiben die Forscher ein intermediäres Stadium. Bei diesen Tieren ist das Heterochromatin mittig angeordnet (invertiert), z.T. in einzelnen voneinander isolierten Inseln, und das Euchromatin findet sich in der Peripherie grüppchenartig oder bandartig strukturiert (Abb. 4).
Noch klarer als die Korrelation mit der Lebensweise, so die Autoren weiter, imponiert jedoch die Übereinstimmung der invertierten Architektur mit anderen Schlüsselmerkmalen der Netzhaut zur Anpassung an das Sehen im Hellen (photopisches Sehen) bzw. in der Dunkelheit (scotopisches Sehen). Dazu gehört u. a. die Dichte der Stäbchenzellen auf der Netzhaut, die Anzahl der Kerne pro Sinneszelle oder der prozentuale Anteil der Zapfenzellen im Verhältnis zu den Stäbchenzellen.
Viertens hat sich noch Folgendes herausgestellt: Die invertierte Architektur des Chromatins im Zellkern ist einzigartig und findet sich bei Vielzellern (Metazoa) nur in den Stäbchenzellen von
Säugetieren. Die gefundene Verteilung dieses Merkmals innerhalb der Ordnung der Säugetiere lässt sich nur durch dessen mehrfach unabhängige, konvergente oder parallele Entstehung erklären (Abb. 5). Dies ist angesichts fehlender Zielorientierung evolutiver Prozesse an sich schon hochgradig unwahrscheinlich. Zudem wäre aber dieses komplexe Merkmal trotz seiner hochgradigen Ähnlichkeit und funktional identischen Vernetzung nicht als ein homologes, sondern als ein analoges Merkmal zu werten. Bauplanähnlichkeit kann also nicht als ein Anzeiger von Abstammungsverwandtschaft gelten (vgl. dazu die kritische Diskussion in Junker 2002). Schon einige der ersten Säugetiere hätten mehrfach und unabhängig, so die vermutete evolutionäre Geschichte bei Solovei et al., die primär konventionelle Kernarchitektur der Stäbchen in die invertierte Form weiter entwickelt und zwar unter dem Anpassungsdruck ihrer nachtaktiven Lebensweise. Nachkommen dieser nachtaktiven Säuger hätten dann ihrerseits wiederum mehrfach und unabhängig voneinander (z. B. auch der Mensch) die primäre Kernkonfiguration der Stäbchen zurück erworben, zusammen mit den morphologischen Spezialanpassungen der Netzhaut an das Tagsehen. Die Autoren vermuten weiter, dass diese Rückkehr zur alten Architektur nicht Folge einer einfachen Akkumulation von schädigenden Mutationen war, sondern aufgrund des selektiven Drucks auf die wahrscheinlich funktionell besser geeignete, konventionelle (alte) Kernarchitektur erfolgte.
Unabhängig von diesen spekulativen evolutionsbiologischen Deutungen lässt sich Folgendes festhalten: Die Existenz der invertierten Kernarchitektur in Stäbchenzellen ist funktionell plausibel und ein weiterer Beleg für die aus wissenschaftlicher Perspektive perfekte Konstruktion der invertierten Netzhaut bei Wirbeltieren. Evolutionsbiologisch stellt das Merkmal und seine Verteilung innerhalb der Säugetiere eine in vielerlei Hinsicht unerwartete Befundkonstellation dar. Vielleicht werden grundsätzlich neue, qualitativ andere evolutionstheoretische Erklärungen die aufgeworfenen Fragen einmal beantworten können. Die bisher favorisierten Mechanismen der Erweiterten Synthetischen Evolutionstheorie sind einmal mehr damit hoffnungslos überfordert.
|
Literatur
- Junker R (2002)
- Ähnlichkeiten, Rudimente, Atavismen. Holzgerlingen.
- Solovei I et al. (2009)
- Nuclear Architecture of Rod Photoreceptor Cells Adapts to Vision in Mammalian Evolution. Cell 137, 356-368.
- Ullrich H, Winkler N & Junker R (2006)
- Zankapfel Auge. Ein Paradebeispiel für „Intelligent Design“ in der Kritik. Stud. Int. J. 13, 3-14.
- Ullrich H (2008)
- Augenblicke – raffiniertes Design der Linsenaugen. Stud. Int. J. 15, 32-35.
|
|  |
