 |
Zankapfel Auge
Ein Paradebeispiel für „Intelligent Design“ in der Kritik von Henrik Ullrich, Niko Winkler & Reinhard Junker
Studium Integrale Journal
13. Jahrgang / Heft 1 - Mai 2006
Seite 3 - 14
|
 |
Zusammenfassung: Das Linsenauge der Wirbeltieriere wird in den aktuellen Kontroversen um die Evolutionstheorie sehr oft als Beispiel gewählt, um evolutionstheoretische Argumente zu verdeutlichen und um Kritik an Makroevolution zurückzuweisen. So könne man heute gerade an diesem Beispiel zeigen, wie graduelle Evolution abläuft. Die „irreduzible Komplexität“ des Auges, welche häufig als Argument für „Intelligent Design“ verwendet wird, könne man widerlegen. Zudem sprächen „Design-Fehler“ am Wirbeltierauge, insbesondere die inverse Lage der Netzhaut, gegen das Wirken eines intelligenten Urhebers und damit indirekt für Evolution.
Alle diese Behauptungen erweisen sich bei näherer Betrachtung jedoch als nur schwach begründet – im Gegenteil: viele evolutionskritische Argumente können heute schärfer formuliert werden als noch zu DARWINs Zeit. In Ursprungsfragen zeigt sich am Beispiel der Entstehung des Sehens und der Augen, daß mehr Wissen nicht unbedingt mehr Antworten zum Entstehungsvorgang bedeutet. So liegt der Ursprung eines ersten einfachsten funktionsfähigen Auges mehr in Dunkeln denn je. Die postulierten Übergänge zwischen verschiedenen Augentypen sind keineswegs graduell wie oft behauptet. Und die auf den ersten Blick ungewöhnliche inverse Orientierung der Netzhaut des Wirbeltierauges ist funktionell voll verständlich; daher eignet sich das Linsenauge der Wirbeltiere kaum als Beispiel für einen Konstruktionsfehler oder gar als Beweis gegen Schöpfung.
|  |
|
Einleitung
Im neu aufgeflammten Streit um die Evolutionstheorie wird ein besonders faszinierendes Organ häufig als Kronzeuge für die widerstreitenden Positionen angeführt: Das Linsenauge der Wirbeltiere. Für die einen ist es der Beleg für eine intelligente Schöpfung schlechthin, für die anderen steht es für das genaue Gegenteil: Es sei ein Pfusch und wäre in einem Geschäft ein „Ladenhüter“ (Steve JONES). Außerdem sei mittlerweile geklärt, wie das Auge durch ungerichtete, graduelle Prozesse entstehen konnte. Wir „können wir die Geschichte erzählen, wie sich fotosensitive Punkte allmählich in lichtempfindliche Krater verwandelten, die näherungsweise die Richtung ermitteln können, aus der das Licht kommt, und wie sich vor den Kratern langsam Linsen bildeten, welche die Fähigkeit zur Aufnahme von Information noch weiter verbesserten“, meinte kürzlich DENNETT (2005, 111), und fügte an: „[D]er Prozess, der diese Designs hervorbringt, ist bar jeglicher ihm innewohnender Intelligenz.“
Die Schwierigkeit einer evolutiven Erklärung der Entstehung des Auges war schon Charles DARWIN bewußt. Er befaßte sich damit im Kapitel VI von Origin of Species unter der Überschrift „Organs of Extreme Perfection and Complication“: „Die Annahme, daß das Auge mit all seinen unnachahmlichen Einrichtungen, die Scharfstellung den verschiedenen Entfernungen anzupassen, wechselnde Lichtmengen zuzulassen und sphärische wie chromatische Abweichungen zu korrigieren, durch die natürliche Auslese entstanden sei, erscheint, wie ich frei bekenne, in höchstem Maße absurd.“ Dann aber schränkt er ein: „Die Vernunft sagt mir, daß wenn zahlreiche Abstufungen von einem unvollkommenen und einfachen bis zu einem vollkommenen und zusammengesetzten Auge, die alle nützlich für ihren Besitzer sind, nachgewiesen werden können, was sicher der Fall ist, – wenn ferner das Auge auch nur im geringsten Grade variiert und seine Abänderungen erblich sind, was gleichfalls sicher der Fall ist, – und wenn solche Abänderungen eines Organes je nützlich für ein Tier sind, dessen äußere Lebensbedingungen sich ändern: dann dürfte die Schwierigkeit der Annahme, daß ein vollkommenes und zusammengesetztes Auge durch natürliche Zuchtwahl gebildet werden könne, wie unübersteiglich sie auch für unsere Einbildungskraft scheinen mag, doch die Theorie nicht völlig umstürzen.“
Im Grundsatz stehen die beiden Perspektiven, die DARWIN selbst kontrastiert, auch heute noch einander gegenüber, obwohl – oder gerade weil – man viel mehr über Augen und das Sehen weiß als zur Zeit DARWINs. So argumentiert Michael BEHE einerseits in seinem bekannten Buch „Darwin’s Black Box“, daß sich DARWIN die Sache noch viel zu einfach vorgestellt habe. Mittlerweile seien biochemische Details des Sehvorgangs bekannt, die sich erst recht gegen eine evolutionäre Entstehung mittels ungerichteter Mutationen und Selektion sperren. Das Auge und speziell die Aufnahme und Verarbeitung des Lichts ist für BEHE heute mehr denn je ein Argument gegen eine graduelle Evolution.
Andererseits hat die molekulare Forschung aber auch erstaunliche Gemeinsamkeiten aller Augen zutage gefördert, die viel mehr als früher einen gemeinsamen Ursprung nahelegen könnten. Dieser wird in evolutionstheoretischer Perspektive natürlich in einem „Ur-Auge“ gesehen, von welchem alle Augentypen abzuleiten seien (Monophylie der Sehfähigkeit; Abb. 2). Bevor die der neuen Sicht zugrundeliegenden molekulargenetischen Entdeckungen gemacht wurden, mußte man annehmen, daß das Sehen im Tierreich mindestens 40 mal evolutiv „erfunden“ wurde, also konvergent entstanden ist (SALVINI-PLAWEN & MAYR 1977). Die neue Sicht der Monophylie des Sehfähigkeit sei viel mehr mit DARWINs Ideen kompatibel, betont GEHRING (2002). Es muß hier aber kritisch angemerkt werden, daß Monophylie unter evolutionstheoretischen Voraussetzungen nur für ein erstes „Primitivauge“ plausibel gemacht wird; bei komplexeren Augentypen muß nach wie vor vielfache Konvergenz angenommen werden. So müßte nach SALVINI-PLAWEN & MAYR (1977, 255) alleine das Linsenauge mindestens 15mal unabhängig entstanden sein (vgl. auch LÖNNIG 1989 und s. u.)
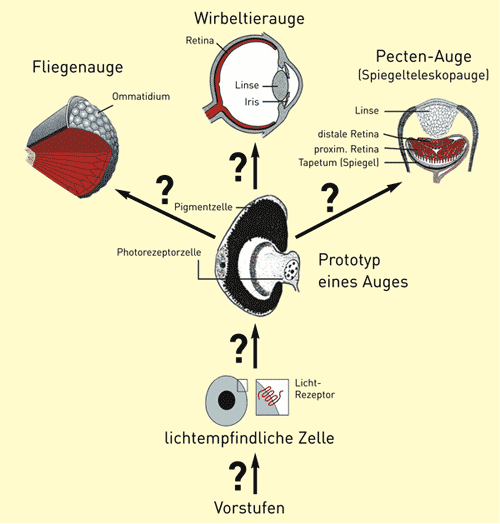 |
| Abb. 2: Ein hypothetisches Schema für die vermutete Evolution verschiedener Augentypen aus einem Prototypen. Eine lichtempfindliche Zelle soll aus unbekannten Vorstufen hervorgegangen sein. Unter der Regie von pax6 entwickelte sich ein einfacher Augen-Prototyp, der dann durch Gen-Rekrutierungen (vgl. Abb. 7) und Veränderungen in den Steuerungsgenen zu komplexeren Augen hinführt. Der hypothetische Charakter dieser Aussagen wird durch Fragezeichen gekennzeichnet. Pecten ist eine Muschel mit einem interessanten Spiegelteleskop-Auge. |
Für viele Biologen ist es ausgemacht, daß die evolutive Entstehung des Auges in den Grundzügen geklärt sei; es gebe nur noch Erklärungslücken zu füllen. Diese Aufassung wird beim Linsenauge der Wirbeltiere häufig noch mit einem „schöpfungskritischen“ Argument unterfüttert. Dessen Netzhaut (Retina) scheint eine Fehlkonstruktion zu sein, weil die lichtempfindliche Seite der Netzhautzellen dem Licht abgewandt ist. Würde ein Schöpfer das Auge so konstruieren? Das Argument hat mittlerweile beachtliche Popularität erlangt, es wird als eines der Standardargumente gegen den „Intelligent Design“-Ansatz schon fast stereotyp angeführt.
Im Folgenden sollen vor dem Hintergrund der aktuellen Kontroversen in einem konzentierten Überblick die wichtigsten Fragen rund um die Entstehung des Linsenauges aufgeworfen und die Argumentationsmuster beispielhaft dargestellt werden. Für Details wird auf die angegebene Literatur verwiesen; der Beitrag soll einen Einstieg ermöglichen.
|
|
Die Entstehung des ersten Auges und das Argument der „irreduziblen Komplexität“
Die Entstehung der heutigen Augen kann man in evolutionstheoretischer Perspektive ganz grob in zwei Abschnitte unterteilen, nämlich in die Entstehung eines ersten Lichtsinnesorgans und dessen weitere Ausgestaltung (vgl. Abb. 2). Der zweite Abschnitt, die Entstehung der verschiedenen Augentypen erfordert seinerseits zahlreiche Schritte, mit denen wir uns weiter unten beschäftigen werden. Zunächst befassen uns mit der Frage, was für die Entstehung eines einfachsten Lichtsinnesorgans erforderlich ist.
|
1. Dunkelphase. Das lichtabsorbierende Pigment Rhodopsin (Opsin + Retinal) ist in die Membranen der Disks der Photorezeptor-Außensegmente eingebaut. Im Rhodopsin liegt das lichtempfindliche Molekül Retinal in der „geknickten“ 11-cis-Form vor (Abb. 3). Das Rhodopsin mit cis-Retinal ist inaktiv.
In der Außenmembran der Rezeptorzelle sind cGMP-gesteuerte Kationenkanäle aktiviert und leiten einen Strom in die Zelle, der zu etwa 80% von Na+ und zu 20% von Ca2+ getragen wird (Dunkelstrom). Ca2+ wird durch ein Austauscherprotein kontinuierlich aus der Zelle entfernt. Bei Dunkelheit ist die cGMP-Konzentration im Zellplasma des Außensegments relativ hoch.
Der Dunkelstrom depolarisiert das Membranpotential auf etwa –30 mV. Dadurch werden an der Synapse (am peripheren Pol der Rezeptorenzelle gelegen) Ca2+-Kanäle aktiviert, die durch Ca2+-Einstrom die Freisetzung von Glutamat aus der Synapse aufrechterhalten. Photorezeptoren sind also im Dunkeln physiologisch gesehen „aktiv“ (Transmitter-Freisetzung).
Das Enzym Phosphodiesterase (PDE) im Zellplasma, das den Abbau von cGMP bewirkt (und damit den Verschluß der Ionenkanäle für Calzium) , wird durch ein Inhibitorprotein (PDE-Inhibitor) gehemmt. Ein wichtiges Signalübertragungsprotein Transducin befindet sich an der Außenmembran der Disks und liegt hier in einer inaktiven Form vor und hat GDP gebunden.
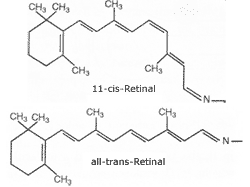 |
| Abb. 3: 11-cis- und all-trans-Retinal |
|
2. Reaktionsphase. Bei Absorption eines Photons wechselt das Retinalmolekül des Rhodopsins in die „gestreckte“ all-trans-Form und zwingt damit das Rhodopsin in eine aktive räumliche Konfiguration, welches so an das Signalübertragungsprotein Transducin bindet. Transducin wiederum spaltet darauf seine aktive Untereinheit mit einem GDP-Molekül ab, die ihr GDP-Molekül wiederum gegen ein GTP-Molekül austauscht und so den PDE-Inhibitor von der PDE des Zellplasmas übernehmen kann. Die PDE ist nun aktiv und zerstört (hydrolysiert) cGMP. Infolgedessen sinkt die cGMP-Konzentration im Zellplasma des Außensegmentes rapide ab, die cGMP-gesteuerten Kanäle der Außenmembran schließen. Der Dunkelstrom wird unterdrückt.
Damit fällt auch die Ca2+-Konzentration ab, weil das Austauscherprotein weiterhin Calcium aus der Zelle transportiert. Durch das Ausbleiben des Dunkelstroms (Einstrom von Ca2+) hyperpolarisiert die Zelle auf etwa –70 mV. Dies führt zum Verschluß der o.g. synaptischen Ca2+-Kanäle. Die Glutamat-Freisetzung hört auf. Photorezeptoren sind bei Lichteinfall physiolgisch inaktiv (keine Transmitterfreisetzung). Der Wechsel zwischen aktiver und inaktiver Synapse erzeugt ein elekronisches Signal, das über die nachgeschalteten Nervenzellen an das Zentrale Nervensystem weitergeleitet wird.
3. Regenerationsphase. Die aktive Untereinheit des Transducins hat eine intrinsische GTPase-Aktivität. Sobald sie GTP gebunden hat, läuft eine Art innerer Uhr: nach kurzer Zeit (< 1 s) wird das gebundene GTP zu GDP und zu anorganischem Phosphat (P) gespalten, und der PDE-Inhibitor wird wieder frei. Sofort bindet er an PDE und stoppt die cGMP-Hydrolyse. Das Rhodopsin-Molekül bleibt jedoch länger aktiv. Es hat keinen intrinsischen Abschaltmechanismus. Einmal aktiviert, kann jedes Rhodopsin hintereinander bis zu etwa 3000 Transducin-Moleküle aktivieren. Abgeschaltet wird Rhodopsin durch ein besonderes Protein: Arrestin. Der Abschaltvorgang beginnt mit der Phosphorylierung des Rhodopsin durch Rhodopsinkinase. Arrestin bindet an das phosphorylierte Pigment und verhindert jede weitere Aktivierung von Transducin. Das phosphorylierte, inaktive Rhodopsin verliert dann sein lichtempfindliches Molekül (Chromophor), wird dephosphoryliert, nimmt ein neues lichtempfindliches Molekül 11-cis-Retinal aus dem Pigmentepithel auf und steht dann für erneute Aktivierung durch ein Photon zur Verfügung.
|
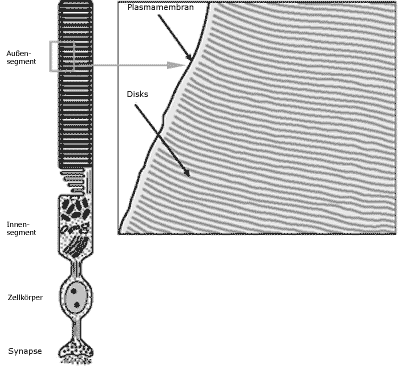 |
| Abb. 4: Links Darstellung einer Stäbchenzelle. Das lichtabsorbierende Pigment Rhodopsin ist in den Disks des Photorezeptor-Außensegments konzentriert. Rechts Längsschnitt durch ein Stäbchenaußensegment mit den isoliert gelegenen Disks nach einer elektronenmikroskopischen Aufnahme. |
|
Minimalausstattung für das Sehen. Um Photonen erfassen und auswerten zu können bedarf es einer zellmorphologischen Minimalausstattung mit einem geeigneten biochemischen Apparat. Der Sehprozeß ist in allen Einzelheiten sehr kompliziert. Mittels einer groben Vereinfachung kann man ihn in etwa wie folgt beschreiben: Beim Auftreffen von Licht auf die Retina wechselwirkt ein Photon mit einem Molekül namens 11-cis-Retinal, welches zur Ausstattung der Lichtsinneszellen gehört (Abb. 3). Dieses klappt innerhalb von Picosekunden zu trans-Retinal um. Die Gestaltänderung des Retinals erzwingt eine Gestaltänderung des mit ihm eng verbundenen Proteins, dem Opsin (Opsin und Retinal bilden zusammen das Rhodopsin). Diese Gestaltänderung bewirkt, daß dieser Proteinkomplex sich nun mit einem weiterem Protein verbindet, dem Transducin. Wenn Transducin mit dem veränderten Rhodopsin in Kontakt tritt, entläßt es ein kleines Molekül namens GDP und bindet stattdessen ein ähnliches, aber doch distinkt unterschiedliches Molekül, das GTP. Das freigesetzte GDP aktiviert – über weitere hier ausgelassene biochemische Schritte – die Phosphodiesterase. Nun ist die Phospodiesterase in der Lage, cGMP (ein chemischer Verwandter von GDP und GTP) zu zerschneiden. Ursprünglich befindet sich in der Zelle relativ viel cGMP, aber sobald die Phosphodiesterase aktiviert wird, verringert sie die cGMP-Konzentration drastisch, wie wenn ein Stöpsel in einer Wanne gezogen wurde.
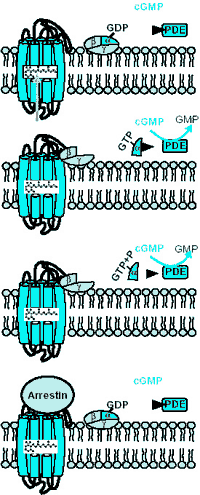 |
Abb. 5: Lichtreaktion der Photozelle I: intrazellulärer Anteil.
Darstellung der Aktivierung und Deaktivierung der Transduktionskette, in deren Ergebnis aus einem Lichtquant ein elektrophysiologisches Signal generiert wird, das an das Gehirn weitergeleitet zur Grundlage der Lichtwahrnehmung dient. (vgl. Kastentext „Wie funktioniert Sehen?“) |
|
In der Zellmembran der Lichtsinneszelle befinden sich nun sogenannte Ionenkanäle,die die Menge an positiven Ionen in der Zelle regulieren. Im Ruhezustand erlaubt der Ionenkanal den Ionen in die Zelle hineinzufließen, während eine Pumpe sie wieder nach außen transportiert. Dieses Zusammenspiel von Ionenkanal und Ionenpumpe hält die Ionenkonzentration in der Sinneszelle in einem engen Bereich konstant. Der Ionenkanal ist aber nur offen, solange er cGMP gebunden hat. Wird nach Lichteinfall die Menge an cGMP durch die Phosphodiesterase verringert, so schließt sich der Ionenkanal. Die Pumpen arbeiten aber weiterhin und so wird die intrazelluläre Ionenkonzentration gegenüber der extrazellulären erniedrigt. Das verursacht eine Änderung des elektrochemischen Ladungspotentials an der Zellmembran (denn die Ionen sind positiv geladen). Letztendlich, über weitere komplexe Schritte, wird diese kurzfristige Änderung des Membranpotentials als Nervenimpuls über den optischen Nerv an das Gehirn weitergegeben. Das Ergebnis ist, wenn es vom Gehirn interpretiert wurde, Sehen. (Für eine genauere Darstellung siehe Kasten).
Nun wird evolutionstheoretisch zurecht argumentiert, daß diese biochemischen Bestandteile nicht allesamt de novo entstehen mußten. Die beim Sehvorgang beteiligten Moleküle könnten schon anderweitige Funktionen in anderen biochemischen Zusammenhängen besessen haben, bevor sie für das Sehen nutzbar gemacht wurden. Tatsachlich haben diese oder ähnliche Moleküle in anderen Lebewesen andere oder ähnliche Funktionen. Neu bei Sehprozeß wären also nicht die Einzelteile des biochemischen Apparats, sondern ihre passende Zuordnung und Kooperation zum Zwecke einer neuen Funktion.
Hier aber greift nun das Konzept der „irreduziblen Komplexität“, das der Sache nach zwar nicht neu ist, unter diesem Begriff aber von dem Biochemiker Michael BEHE (1996) erneut in diese Diskussion über die Entstehung biologische Neuheiten eingeführt wurde.
Das Argument der „irreduziblen Komplexität“. BEHE (1996, 39) bezeichnet ein System als irreduzibel komplex, wenn es notwendigerweise aus mehreren fein aufeinander abgestimmten, interagierenden Teilen besteht, die für eine bestimmte Funktion benötigt werden, so daß die Entfernung eines beliebigen Teils die Funktion restlos zerstört. Ein solches System wird nachfolgend als IC-System bezeichnet. Aus der Existenz von IC-Systemen kann man ein IC-Argument ableiten. Damit ist gemeint: Es ist nicht möglich, ein IC-System schrittweise durch ungerichtete graduelle Prozesse aufzubauen. Denn solange das System nicht alle für die Ausübung der betreffenden Funktion erforderlichen Teile besitzt, wäre es aufgrund seiner Funktionslosigkeit selektionsnegativ oder bestenfalls selektionsneutral (falls das System sehr einfach ist). Das heißt: IC-Systeme sind so gestaltet, daß die Selektion erst greifen kann, wenn das System komplett ist. Das Konzept der irreduziblen Komplexität berücksichtigt also ausdrücklich den Selektionsaspekt. Außerdem berücksichtigt das IC-Argument die Möglichkeit, daß die Einzelteile des IC-Systems auch in anderen Zusammenhängen eine andere Funktionen ausüben könnten. Details und eine Reihe von Kritikpunkten am IC-Argument diskutiert JUNKER (2005a).
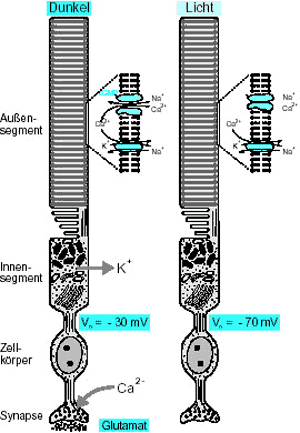 |
Abb. 6: Lichtreaktion der Photozelle II: membranabhängiger Anteil.
Änderungen des Membranpotentials der Sinneszelle durch den Lichteinfall werden an benachbarte Nervenzellen über Synapsen weitergeleitet. (vgl. Kastentext „Wie funktioniert Sehen?“) |
|
Kommen wir auf ein erstes hypothetisches lichtempfindliches System zurück, ähnlich dem, dessen Biochemie und Morphologie oben kurz für das heutiges Sehen charakterisiert wurde. Wie haben wir ihn uns vorzustellen?
Ein einfacher hypothetischer Apparat müßte folgende Grundkomponenten aufweisen (vgl. auch Tab. 1):
- ein lichtempfindlicher Proteinkomplex (Opsin und Retinal sowie passende Systeme zur Aktivierung)
- eine Signalweiterverarbeitung und Verstärkung (Transducin, GDP, cGMP, Phosphodiesterase und dazu passende Deaktivierungssysteme)
- eine Ausgabeinheit (Ionenkanäle, Ionenpumpe und bei Mehrzellern Nervenzellen zur Signalauswertung).1
GEHRING & IKEO (1999) fordern außerdem noch eine genetische Steuerungseinheit, ein pax6-Homologon, welches den Aufbau des „Auges“ steuert. Es handelt sich offenkundig, selbst in ihrer radikalen Vereinfachung, um eine IC-Struktur. Auch wenn alle ihre Elemente vorher in anderen funktionellen Zusammenhängen bereits vorhanden gewesen sein sollten, würde ihre Kopplung und Abstimmung aufeinander zahlreiche aufeinander abgestimmte Schritte erfordern. Für eine solche konzertierte Aktion sind die bekannten, ungelenkten Evolutionsmechanismen ungeeignet.
Überlegungen zur Evolution der Augen starten gewöhnlich mit einem bereits funktionsfähigen, wenn auch vergleichsweise einfachen Sehapparat. Ein solches Minimalauge müßte aus einem lichtempfindlichen System (s. o.) bestehen. Darüber hinaus müßte es von einer (einseitigen) Abdunklung umgeben sein, da sonst keine Lichtrichtung wahrgenommen werden kann. Das gebildete Signal muß weitergeleitet und durch das Nervensystem oder auf anderer Grundlage ausgewertet werden, sonst wäre das „Auge“ wertlos. Für die Entstehung eines Minimalauges gibt es bislang keine realistischen Modelle. Daß dem so ist, geht aus einer vielzitierten Arbeit von GEHRING & IKEO (1999) hervor, denn sie schreiben: „Wenn der Prototyp [eines Auges] evolviert ist, vermutlich durch stochastische Ereignisse, dann kann Selektion ihn [...] optimieren.“ Diese „stochastischen“ und damit zufälligen „Ereignisse“ spiegeln die Situation der Ursuppenproblematik wider: Bauteile müssen durch unbekannte Naturkräfte (hier „stochastische Ereignisse“ genannt) entstehen und zusammengefügt werden, um eine Urzelle bzw. einen Augenprototyp zu ergeben. Somit wird auch von Seiten der Evolutionsvertreter festgehalten, daß „Voraussetzung für die Evolution eines Auges mindestens die Entstehung von Rhodopsin (das lichtempfindliche Prinzip aller tierischen Augen) und des pax6-Gens [Regulationsgen; mehr dazu siehe unten] ist. Der Augen-Prototyp kann nicht durch Selektion erklärt werden, denn Selektion kann die Evolution nur dann vorwärtsbringen, wenn das Auge wenigstens zu einem kleinen Teil funktioniert“ (GEHRING & IKEO 1999). Wie oben beschrieben, muß zu diesem Prototyp noch etwas mehr gehören. Damit bleibt die Frage offen, ob ein solcher Prototyp von einem Auge durch zufällige Ereignisse entstehen kann. Dies kann aus guten Gründen bezweifelt werden.
|
• eine morphologische Kompartimentierung auf zellulärem und subzellulärem Niveau
• ein lichtempfindlicher Proteinkomplex (Rhodopsin)
• ein Überträgerprotein (Transducin), das an Rhodopsin gebunden selbst chemisch aktiviert wird
• ein Enzyminhibitor, dass durch das Überträgerprotein an- und ausgeschaltet werden kann
• ein Enzym, dass die Konzentration von cGMP im Zellplasma senkt
• cGMP abhängige Ionenkanäle in der Zellmembran für die Einfuhr von Kalzium- und Natriumionen
• ein aktives Austauscherportprotein, dass Kalziumionen kontinuierlich aus der Zelle schafft
• Deaktivierungssysteme, die die aktivierten Untereinheiten in einen inaktiven Zustand zurückführen
• eine Kopplung des Lichtempfängersystems mit anderen intrazellulären Funktionssystemen (z.B. Nervenzellen).
|
Tab. 1: Grundkomponenten eines hypothetischen einfachen Augenapparats.
|
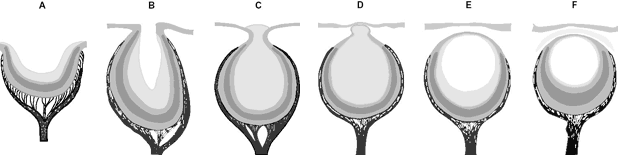 |
Abb. 7: Morphologische Serie von Augentypen von Prosobranchier-Schnecken.
A, B Grubenauge (Gattungen Patella, Pleurotomeia), C Lochkameraauge (Haliotis), D geschlossenes Auge (Turbo), E, F Linsenaugen (Murex, Nucella). (Nach Salvini-Plawen & Mayr 1977).
Lönnig (1989, 100) weist darauf hin, daß die Serie keine Abstammungslinie bildet und daß es auch Argumente dafür gibt, sie von rechts nach links als Degenerationsreihe zu lesen. |
|
Grünalgen-Auge. Als Beispiel für ein Minimalauge wird häufig das Auge von Grünalgen wie Chlamydomonas genannt. Das Rhodopsin ist bei diesen Algen aber völlig anders als bei Tieren aufgebaut und kann damit nicht ohne weiteres als Prototyp für ein tierisches Auge gelten – im Gegenteil, es muß als unabhängig entstanden gelten und verschärft so eher die Problematik.
|
|
Kann eine graduelle Evolution der heutigen Augentypen plausibel gemacht werden?
Vergleichende Biologie. Häufig wird als Erklärung für die Entstehung des Linsenauges auf die Existenz morphologischer Serien verschiedener Augentypen verwiesen: Flachauge – Grubenauge – Lochkameraauge – Linsenauge (Abb. 7); damit sei eine schrittweise Entstehung plausibel (SALVINI-PLAWEN & MAYR 1977, 209). Bereits Charles DARWIN argumentierte in diesem Sinne (vgl. obiges Zitat), und bis heute gelten Formenvergleiche – mittlerweile auch auf molekularem Sektor – als maßgebliche Informationsquelle über die Abfolge von Evolutionsprozessen. So schreibt beispielsweise DENNETT (2005, 111): „Wir können nicht alle Details dieses Prozesses rekonstruieren, doch es gibt noch heute überall im Tierreich viele Arten von Augen, die diese Zwischenstadien repräsentieren.“ Oder ARENDT (2003, 563) in Bezug auf molekulare Ähnlichkeiten: „Wenn wir die molekularen Kombinationen der Zelltypen heutiger Augen von Tieren vergleichen, können wir ihre evolutive Geschichte rekonstruieren“ (Hervorhebung nicht im Original). Diese Vorgehensweise kann in mehrfacher Hinsicht kritisiert werden:
- Es handelt sich um ein rein vergleichend-biologisches Argument (auch auf der molekularen Ebene); ein Formenvergleich oder ein genetischer Vergleich gibt jedoch keine Auskunft über Evolutionsmechanismen; eine Aneinanderreihung verschiedener Formen belegt in keiner Weise ein evolutives Hervorgehen auseinander. (Zur Mechanismenproblematik siehe weiter unten.)
- Die Abfolge ist keineswegs durchweg gleitend und allmählich, sondern bei genauerer Analyse an vielen Stellen deutlich sprunghaft. Der Übergang von einem Flachauge zu einem Grubenauge mag als mikro-evolutiver Spezialisierungsvorgang gelten können, aber schon bei der Entstehung des Lochkameraauges muß bedacht werden, daß die gegenüber dem Grubenauge zusätzlich gewonnene Bildinformation auch verarbeitet werden muß, wenn sie einen Selektionsvorteil bieten soll. Der Umbau muß daher als „konzertierte Aktion“ mit dem Ausbau von Gehirnleistungen erfolgen, und das kann kaum als gradueller Anpassungvorgang beschrieben werden, sondern hier ist eine teilweise Neukonzeption erforderlich.
- Alle evolutionären Theorien beachten desweiteren entwicklungsphysiologische Zusammenhänge der Individualentwicklung (Ontogenese) nur ungenügend. Das heißt, ein erfolgversprechender phylogenetischer Wandel des Auges muß auch garantieren, daß immer funktionierende Zwischenstufen für die embryonale Augenentwicklung im sich entwickelnden Gesamtorganismus vorhanden sind. Die Bildung und Entstehung des Auges während der Individualentwicklung wird durch zahlreiche Induktionskaskaden gesteuert und wirkt ihrerseits auf die Bildungsprozesse des Individuums zurück (Gehirnentwickung, Knochenbau etc.) Man darf also bei vermuteten Übergängen von einer Augenform zu anderen nicht nur das fertige Auge (i.S. von „in einem erwachsenen Organismus“) betrachten, sondern muß die gesamte Individualontogenese (d.h. die Entwicklung vom Ei zum Erwachsenen) der hypothetischen Zwischenstadien bei einer Evolution passend mit verändern.
Ein grundlegender Umbau wäre insbesondere beim Übergang vom Lochkameraauge zum Linsenauge erforderlich. Beispielhaft sei zu diesem Übergang aus LÖNNIG (1989) zitiert (über Augentypen bei Muscheln): „Es bedürfte Hunderter von Zwischenstufen, um vom gelartigen Glaskörper (vitreous mass) durch Mikromutationen und Selektion zum Linsenauge ... zu gelangen: Das Gel müsste schrittweise reduziert und die zelluläre Linse über viele Zwischenstufen aufgebaut werden. Hier stellt sich wohl auch schon das Synorganisationsproblem: Aufbau und Reduktion sollten bei vielen Schritten auf die Dauer aufeinander abgestimmt sein. Weiter erhebt sich die Frage nach dem Selektionswert solcher Zwischenstufen.“ Ein scharfes Bild benötigt beim Lochkameratyp eine kleine Öffnung. Für die Linse des Linsenauges wird eine größere Öffnung benötigt – wie soll die Selektion mit diesem Widerspruch fertig werden? Und so stellen sich viele weitere Fragen, wenn man anfängt, die Details zu betrachten, z. B. wie der Apparat entstehen konnte, der eine Scharfstellung durch Verformung der Linse ermöglicht oder wie die Hell-Dunkel-Regulation mittels der Iris installiert wurde usw. Die Crux der „Beweisführung“ mittels morphologischer Serien ist eine äußerst oberflächliche Betrachtung, die der biologischen Realität der Komplexität des Linsenauges nicht im entferntesten gerecht wird.
Die vergleichenden Betrachtungen bieten also keine Erklärung dafür, wie die verschiedenen Augentypen evolutiv entstanden sind. Im folgenden soll ein Ansatz vorgestellt werden, der auf neueren molekulargenetischen Befunden gründet.
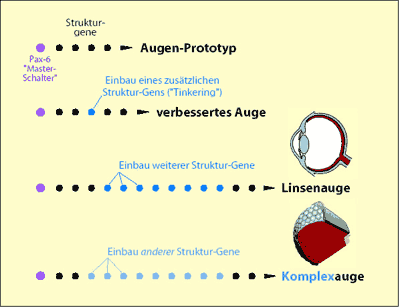 |
Abb. 8: Stark schematisierte Darstellung des hypothetischen „Gene-Tinkerings“ am Beispiel des Auges. Ein Augen-Prototyp wird zunächst als gegeben vorausgesetzt. Die weitere hypothetische evolutive Entwicklung erfolgt durch sukzessive Einfügung weiterer Gene, die unter der Kontrolle des Master-Gens (Hox-Gen, hier Pax-6) stehen. Die verschiedenen Augentypen sollen demnach durch unterschiedlichen Einbau untergeordneter Gene entstanden sein. Das Hox-Gen bleibt dasselbe und kann daher die Entwicklung verschiedener Augentypen induzieren.
|
|
Genrekrutierung, Gen-Tinkering. Der genetische Hintergrund der Formbildung der Augen ist äußerst komplex und selbst für einfache Augentypen kaum verstanden. Relativ gut untersucht sind bislang einige Steuerungsgene, das prominenteste ist pax6. Dieses Gen kontrolliert die Augenentwicklung auf höchster Ebene und ist in der Lage, eine nachfolgende Kaskade von etwa 2500 Genen in Gang zu setzen, die für die Formbildung des Auges wichtig sind (HALDER et al. 1995). Das pax6-Gen wurde bei einer ganzen Reihe von Lebewesen nachgewiesen (Insekten, Tintenfische, Fadenwürmer, Fische, Amphibien, Mäuse, Mensch). Es konnte gezeigt werden, daß pax6 aus der Maus die Augenentwicklung bei Fruchtfliegen (Drosophila) anstoßen kann. Das dadurch entstehende Auge ist natürlich ein Insektenauge. Doch aufgrund dieser Zusammenhänge wird ein gemeinsamer Vorfahr postuliert, der ein durch pax6 kontrolliertes Minimalauge besaß.
Die Entwicklung von einem Minimalauge hin zu einem komplexen Wirbeltierauge soll in der Hauptsache durch Veränderung der Genregulation und durch Genrekrutierung zustande gekommen sein (GEHRING 2005). Damit ist gemeint, daß Proteine, die in anderen Zellen an normalen Stoffwechselreaktionen beteiligt sind, in einem neuen Funktionszusammenhang benutzt werden, hier z. B. als Linseneiweiße (Crystalline), vgl. dazu SHIMELD (2005).
Erstaunlicherweise kommen Proteine bzw. ähnliche Abschnitte von Proteinen (Proteindomänen) und die zugrundeliegenden Genabschnitte im ganzen Organismenreich immer wieder in ähnlicher oder sogar gleicher Form vor, jedoch oft in ganz unterschiedlichen Funktionszusammenhängen. Durch hypothetische evolutive Prozesse könnten bestehende Domänen aneinander „geflickt“ oder Proteine in neue Funktionszusammenhänge eingeschleust worden sein (vgl. Abb. 8). Solche Vorgänge werden unter Gen-Tinkering („Flickschusterei“ mit Genen) subsummiert. Bislang gibt dafür nur wenige direkte Beobachtungen und sie erscheinen vergleichsweise einfach (Überblick bei NEUHAUS 2002). Makroevolution durch Gen-Tinkering belegen die beobachteten Fälle nicht. Eine Einschätzung der evolutiven Möglichkeiten durch Gen-Tinkering ist aufgrund von Datenmangel bislang kaum möglich. Darüber hinaus bleibt die Frage offen, woher Domänen und funktionelle minimale Anfangszustände kommen. Jeder Baustein, der bei einem evolutiven „tinkering“ verwendet wird, muß ja irgendwann einmal entstanden sein. Die Annahme, dass die benötigten Domänen in einem anderen Zusammenhang evolviert seien, verschiebt nur das Problem. Die Hypothese eines Gen-Tinkerings als Ursache für die Evolution der komplexeren Augentypen ist also bislang theoretisch äußerst spekulativ und experimentell nicht belegt.
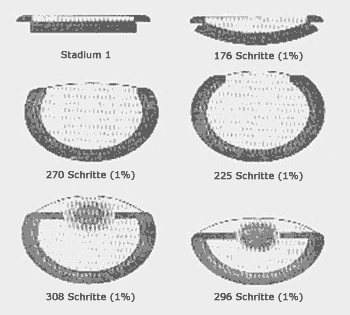 |
| Abb. 9: Einige repräsentative Schritte im Evolutionsmodell von Nillson & Pelger (1994). Das Anfangsstadium ist eine flache Struktur aus einer lichtempfindlichen Schicht mit einer Pigmentschicht darunter und einer transparenten Schutzschicht darüber. Angegeben ist jeweils die Anzahl der Schritte (bei 1% Änderung je Schritt), die notwendig waren, um die vorliegende Struktur zu erreichen. Die verschiedenen Stadien stammen aus mehreren Versuchsreihen. |
|
Die Computersimulation von NILSSON & PELGER (1994). Die einzige berichtete Computersimulation zu diesem Thema geht von einer einfachen lichtempfindlichen Vorstufe des Auges aus und kommt zu dem positiven Schluß, daß die Entwicklung eines Auges problemlos denkbar sei. Mit maximal 400.000 Schritten gelange man von einem einfachen Flachauge zum Linsenauge. DENNETT (2005, 111) spielt wahrscheinlich darauf an, wenn er schreibt, wir hätten „detaillierte Computermodelle, die bestätigen, dass dieser schöpferische Prozess so abläuft, wie die Theorie ihn vorhersagt.“
Doch diese Simulation erklärt nicht das, was sie vorgibt. Zum einen handelt es sich um eine Veränderung eines bereits funktionsfähigen Systems im Sinne einer technischen Optimierung (Abb. 9). Die Autoren mußten eine lichtempfindliche Fläche (die spätere Netzhaut) ebenso vorgeben, wie eine Schutzhaut (die spätere Hornhaut) und eine lichtdurchlässige Schicht (die spätere Linse). Außerdem war natürlich der biochemische Sehapparat von Anfang an erforderlich. Eine bereits relativ komplexe Struktur zu optimieren ist ein grundlegend anderes Problem als eine solche Struktur erstmals zu entwerfen.
Zum anderen wird das Modell von NILSSON & PELGER der biologischen Realität des Baus des Linsenauges in keiner Weise gerecht. HANSEN (2003, 83f.) kritisiert an diesem Modell, es werde vorausgesetzt, daß genetische Variation bei bestimmten Merkmalen wie Größe, Form und optische Eigenschaften der beteiligten Gewebe unabhängig von der Variation anderer Merkmale und vom übrigen Organismus sei. Es gehe weiter davon aus, daß eine kontinuierliche Variation vom anfänglichen Flachauge bis zum finalen komplexen Auge Schritt für Schritt selektiv bewertet werde. Das Modell sei daher mit der Evolution eines eindimensionalen quantitativen Merkmals mit unbegrenzter Variabilität vergleichbar, so als ob das Auge wie ein einzelnes Merkmal evolvieren könne. Dies aber sei in Bezug auf die Evolvierbarkeit des Linsenauges alles andere als eine pessimistische Annahme, wie NILSSON & PELGER behaupten. Ein so komplexes Organ wie das Auge kann mit einem derart einfachen eindimensional variierbaren Merkmal keinesfalls verglichen werden. Die Unabhängigkeit der Variation der einzelnen Elemente des Auges voneinander und vom Rest des Organismus ist daher eine ausgesprochen unrealistische Annahme. Das heißt: Der Komplexität und Vernetztheit von organismischen Bauplänen wird in der NILSSON-PELGERschen Computersimulation nicht einmal entfernt Rechnung getragen; solche Modellrechnungen sind daher gemessen an der heute bekannten biologischen Realität unangemessen, ja sie sind im Grunde genommen irrelevant.
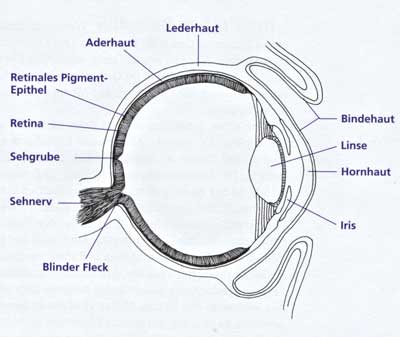 |
| Abb. 10: Querschnitt durch ein Wirbeltier-Auge. (Nach Adler & Farber 1986) |
|
Bei alledem muß auch berücksichtigt werden, wie bereits oben erwähnt, daß Teile des Auges sich vom embryonalen Gehirngewebe ableiteten. Miteinander in Zusammenhang stehende Veränderungen müssen demnach, ohne Selektion von außen, auch am embryonalen Gehirn vorausgesetzt werden. Evolviert also das Auge, müssen viele andere Teile eines erwachsenen Organismus und des sich entwickelnden Organismus (während der Embryonalentwicklung) miteinander abgestimmt werden. Damit wird aber eine mögliche Evolution immer unwahrscheinlicher, da viele positive und aufeinander abgestimmte, komplexe Mutationen nötig wären. Dies widerspricht dem biologischen Befund, daß Mutationen einzeln und ungerichtet auftreten und verringert die Wahrscheinlichkeit ihrer Entstehung, statt sie zu erhöhen.
Schlußfolgerungen. Die vorhandene Datenlage belegt einerseits eine enorme Vielfalt und Komplexität hinsichtlich des Aufbaus, der Funktionsweise und der embryonalen Entwicklung bei den bekannten unterschiedlichen Augentypen. Andererseits finden sich bei allen Augentypen überraschende Gemeinsamkeiten (Sehpigment, Steuerungsgene). Auf dieser Grundlage konnten bislang nur pauschale und spekulative Hypothesen über die Evolution des Auges entwickelt werden. Vieles spricht dafür, daß die funktionellen Zwischenstufen (Basisfunktionszustände sensu SCHERER 1995) zwischen den verschiedenen Augentypen einen viel zu großen Abstand haben, um durch die aktuell favorisierten evolutionären Mechanismen überbrückt werden zu können, doch muß dies derzeit offen bleiben. Die oft geäußerte Behauptung, man verstehe heute in Grundzügen wie z. B. das Linsenauge der Wirbeltiere evolutiv entstanden sei, ist durch die bekannten Daten jedoch nicht gedeckt.
|
|
Ist das Linsenauge eine Fehlkonstruktion?
Das Linsenauge ist nicht nur ein Zankapfel in der Frage nach den Mechanismen der Makroevolution und nach der evolutionären Herleitung irreduzibel komplexer Strukturen. Es ist auch der haushohe Favorit unter den Beispielen für „schlechtes Design“, die in der Diskussion um Evolution und Schöpfung immer wieder genannt werden. So wird verbreitet angenommen, daß die Funktion des Wirbeltier-Auges unvollkommen sei, denn die Photorezeptoren der Netzhaut liegen vom Licht abgewandt nach innen gerichtet (inverse Lage; Abb. 10). Stellvertretend für viele ähnlich lautende Einschätzungen sei noch einmal Dennett (2005, 111) zitiert: „Kein intelligenter Designer würde so plumpes Flickwerk wie den blinden Fleck in die Netzhaut packen.“ Der blinde Fleck entsteht dadurch, daß die von den Netzhautzellen abführenden Nervenendigungen ins Augeninnere abgehen und dann gesammelt an einer bestimmten Stelle zum Gehirn geleitet werden. An dieser Stelle ist kein Platz für Netzhautzellen; daher ist das Auge dort blind. Diese Konstruktion sei alles andere als optimal, wird argumentiert; ein Schöpfer hätte das anders gemacht, wie ja auch die Tintenfische beweisen, die ein sehr ähnliches Linsenauge besitzen, deren Netzhautzellen den gesamten Augenhintergrund bedecken aber evers angeordnet sind, d. h. so, daß die lichtempfindlichen Seiten direkt dem einfallenden Licht zugewandt sind. Die inverse Lage der Netzhaut im Wirbeltierauge könne dagegen von dessen evolutiver Vorgeschichte her verständlich gemacht werden. Genauere Begründungen dieser Auffassung scheinen aber schwierig zu sein. Sie basieren meist auf einer phylogenetischen Interpretation der ontogenetischen Augenentwicklung bei den Wirbeltieren (Drews 1993). Das heißt: Abfolgen; die während der embryonalen Entwicklung des Auges auftreten, werden mit einer vermuteten Abfolge von verschiedenen Augentypen während der Evolution in Beziehung gesetzt. Während bei den Tintenfischen die Netzhaut, Linse und Iris aus eingesenktem ektodermalen (oberflächlichen) Gewebe hervorgeht, entsteht die Netzhaut und die Iris bei den Wirbeltieren aus einer embryonalen Ausstülpung des Zwischenhirns und nur die Linse aus eingesenktem Ektoderm (vgl. dazu Tab. 2). Heutige oder fossile Zwischenformen, die dazwischen einen möglichen Übergang zeigen, existieren nicht. Deshalb ist es nicht verwunderlich, wenn Dawkins schreibt (1986, 93): „Ich kenne die genaue Erklärung für diesen seltsamen Zustand nicht. Die relevante Evolutionsperiode liegt so lange zurück.“

|
| Tab. 2: Vergleich der ursprünglichen embryonalen Gewebetypen der Augenentwicklung bei Tintenfischen und Wirbeltieren. (Nach Fioroni 1999) |
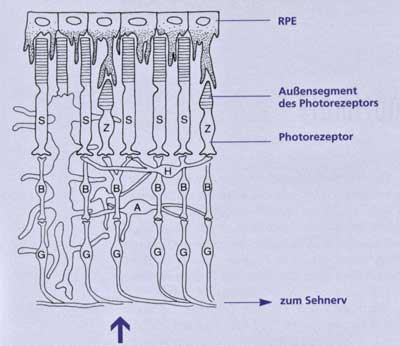 |
Abb. 11: Schematisches Diagramm einer Wirbeltier-Retina. Der dicke Pfeil zeigt die Richstung des einfallenden Lichts an.
A Amakrine Zelle, B Biploar-Zelle, G Ganglienzelle, H Horizontalzelle, S Stäbchen, Z Zapfen. (Nach Adler & Farber 1986) |
|
Funktionelle Gründe für die inverse Lage. Es gibt jedoch wichtige funktionelle Kriterien, warum die Photorezeptoren der Netzhautzellen in der inversen Lage angeordnet sind. Auf die ontogenetischen Zusammenhänge der Augenentwicklung, die zur inversen Lage der Netzhaut führen, wurde bereits hingewiesen. Zweitens zeigt die Netzhaut im Bereich der Macula (der Stelle des schärfsten Sehens) einen fast einschichtigen Aufbau, hier liegen vor allem Zapfenzellen (wichtig für das Tagsehen und Farbsehen) an der Oberfläche ohne Überlagerung durch andere retinale Zellschichten und garantieren eine fast 100% Lichtausbeute (vgl. Neuhaus & Ullrich 2000, 3). Drittens, die Struktur und Funktion der Photorezeptoren wird durc
h ein besonderes Gewebe, das häutige Retinale Pigment-Epithel (RPE) aufrechterhalten. Es liegt direkt unter der Netzhaut (Abb. 11) und unterstützt die Photorezeptoren in dreierlei Hinsicht: Es erneuert die Photopigmente, entfernt abgestoßene Außensegmente der Photorezeptoren und bildet eine undurchsichtige Schicht, die Streulicht absorbiert. Weitere Funktionen sind Schutz vor den Auswirkungen energiereicher UV-Strahlung, Abfuhr
von überschüssiger Wärme und leichter Zugang zu den über das Blut angelieferten benötigten großen Energiemengen für den Sehvorgang (vgl. Denton 1999; Isau 2005). Das RPE ist also für die Regeneration und Funktion der Netzhaut unerläßlich. Damit diese Funktionen ausgeübt werden können, ist eine unmittelbare Nachbarschaft zu den lichtsensitiven Teilen der Netzhautzellen notwendig. Hewitt & Adler (1994, 67) stellen fest: „Betrachtet man die diversen Funktionen der RPE-Zellen ... bleibt kein Zweifel daran, daß für den normalen Ablauf des Stoffwechsels das RPE für die Funktion der äußeren Retina notwendig ist. Durch die Natur dieser Zusammenarbeit ist es notwendig, daß das RPE und die Photorezeptoren räumlich eng miteinander verbunden sein müssen, damit das Auge normal arbeitet.“
Diese höchst effizienten Aspekte der Entwicklung (Ontogenese), Struktur und Funktion werden meistens mißachtet, wenn unter der Voraussetzung von Evolution behauptet wird, es liege ein Konstruktionsfehler vor; tatsächlich sind sie aber für das Verständnis der Funktionsweise einer inversen Retina unerläßlich.
Vergleich mit anderen Linsenaugen. Wenn man trotz dieser funktionellen Begründungen immer noch behauptet, das Linsenauge der Wirbeltiere sei fehlkonstruiert, muß man durch einen Vergleich zeigen, daß es anders besser geht und daß es nachweislich eine funktionelle Schwachstelle im Gesamtsystems des optischen Apparates (inkl. des zentralen Nervensystems) gibt. Letzteres wird durch den enormen Erkenntniszugewinn hinsichtlich der funktionellen und bio-physikalischen Möglichkeiten der Linsenaugen bei den Wirbeltieren mehr als konterkariert. Ein besseres Linsenauge hat aber noch niemand konstruiert; daß es besser konstrierbar ist, kann also allenfalls vermutet und nicht einfach behauptet werden. Eine bloße Zeichnung wie das Bild in Nesse & Wiliams (1997) reicht dafür sicher nicht aus (Abb. 12).
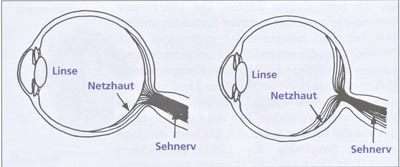 |
Abb. 12: Das menschliche Auge wie es nach Nesse & Williams (1997) sein sollte, und wie es tatsächlich gebaut ist.
|
|
Bleibt noch die Möglichkeit, den Vergleich mit dem Linsenauge der Tintenfische heranzuziehen. Das Tintenfisch-Auge ist evers gebaut, d. h. die Lichtrezeptoren liegen in der Netzhaut dem Licht zugewandt. Die Auflösung ist vergleichbar mit der des Wirbeltierauges. Die angesprochenen Aufgaben der Versorgung und des Recyclings von Zellresten werden hier – bildlich gesprochen – durch einen „Versorgungsschacht“ in der Mitte der Retinazellen gewährleistet.
Im Vergleich wird zunächst deutlich, daß in Lebewesen verschiedene Konzepte verwirklicht sein können, um ein Problem, hier die Abfallentsorgung und Energieversorgung von Zellen, zu lösen. Weitergehende Schlußfolgerungen sind aber problematisch, da das Tintenfischauge auf ein Leben im Wasser, das Wirbeltierauge dagegen bei den meisten Arten für das Leben an Land zugeschnitten ist. Das könnte eine Begründung für die Unterschiedlichkeit der Augen sein. Noch abgesehen von dem problematischen Vergleich wurde ohnehin nie gezeigt, daß das Tintenfischauge dem Linsenauge der Wirbeltiere (vor allem an Land) funktionell überlegen sei.
Inverse und everse Auge stehen sich gleichberechtigt gegenüber, und es ist nicht leicht möglich zu zeigen, in welche Richtung man die Retinatypen funktionell verbessern verändern sollte, ohne eine Abnahme ihrer Empfindlichkeit im Gesamtsystem zu riskieren.
Ganzheitsaspekt. Bei den Betrachtungen über mutmaßliche Konstruktionsfehler muß man schließlich bedenken, daß die Organismen Ganzheiten darstellen. Es ist unbiologisch, Organe oder gar Einzelteile von ihnen isoliert zu betrachten, und ihre Integration im Körper sowie die ontogenetischen Entstehungsbedingungen zu mißachten. Im gesunden Zustand ist von all den vermeintlichen „schlechten Designs“ nichts zu merken. Wir leiden weder am blinden Fleck noch an der inversen Lage der Netzhaut. „Die funktionelle oder konstruktive Bewertung von Detailstrukturen des Wirbeltierauges (z.B. der Retina) ist bedeutungslos, wenn die verschiedenen Ebenen ihrer integrativen Verknüpfung mit anderen Elementen im biologischen Gesamtsystem des visuellen Sinnes unberücksichtigt bleiben“ (Neuhaus & Ullrich 2000, 3).
Verdacht von Design-Fehlern als Forschungsanreiz. Selbst wenn die inverse Lage der Retina unverstanden wäre (was sie offenkundig nicht ist), wäre es forschungshemmend, vorschnell evolutive Gründe für vermeintliche Konstruktionsfehler verantwortlich zu machen. „Die Suche nach Funktionen ist ein sinnvolles Forschungsprogramm, das unsere unzulänglichen Funktionskenntnisse vorantreiben und die vielfachen Hinweise auf sogenannte funktionslose Organe eliminieren wird“, schrieben vor über 30 Jahren Gutmann & Peters (1973) den Biologen ins Stammbuch. Entsprechendes gilt auch für mutmaßlich fehlerhafte Konstruktionen.
Theologische Anmerkungen. Der Hinweis, das Auge der Wirbeltiere sei mit seiner inversen Retina eine „Fehlkonstruktion“ ist eigentlich ein verstecktes theologisches Argument: Man macht eine Aussage darüber, wie ein Schöpfer gehandelt haben sollte – und wie nicht. Es werden also Mutmaßungen über die Handlungsweisen eines Schöpfers geäußert, z. B. daß er keine suboptimalen Konstruktionen erschaffen würde. Ohne konkrete Vorstellungen über das Handeln Gottes und das Gottesbild können solche Argumente nicht aufgestellt werden! Die Argumentationskette ist wie folgt: 1. Es gibt einen allweisen, allmächtigen Schöpfer. 2. Man unterstellt eine Fehlkonstruktion. 3. Aufgrund der Fehlkonstruktion und einer Unterstellung („Ein allweiser Schöpfer täte so etwas nicht!“), kommt man zu dem Schluß, daß kein Schöpfer gehandelt hat. Im Kern handelt es sich um eine biologische Ausformung der klassischen Theodizee-Frage, ob die Allmacht Gottes mit der Existenz des Bösen (hier: vermeintliche biologische Unvollkommenheiten) vereinbar sei. Näheres dazu in Junker (2002, 69-70); allgemeines zum Unvolkommenheitsargument (Junker 2002, Kap. 4) sowie im Internet (Junker 2005b).
|
|
Schlußfolgerungen
Das IC-Argument von Darwin bis heute. „Es ist eingewendet worden, dass, um das Auge zu modificieren und es doch als vollkommenes Werkzeug zu erhalten, viele Veränderungen gleichzeitig bewirkt worden sein müssen, was, wie man meint, nicht durch natürliche Zuchtwahl geschehen könne“ (Darwin 1859). Dieser Einwand trifft auch heute – nach einer enormen Ansammlung von Kenntnissen über das Auge – unverändert, wenn nicht sogar in verschärfter Form zu.
Oft wird der Ansatz des „Intelligent Design“ damit in Frage gestellt, daß zunehmendes Wissen die vermeintlichen Hinweise auf einen intelligenten Urheber eliminieren werde. Damit wäre das ID-Konzept falsifizierbar. Im Falle des Linsenauges zeigt sich jedoch: Je mehr man weiß, desto deutlicher treten die „Design-Signale“ wie irreduzible Komplexität zutage. Darauf weist Michael Behe (1996) am Beispiel des Auges, aber auch anhand einer Reihe weiterer Beispiele hin: „Für Darwin war der Sehvorgang eine Black Box, heute jedoch sind wir dabei, durch harte Arbeit von Biochemikern auf die Fragen rund um das Sehen Antworten zu finden“ (Behe 1996b). Weitere Forschung kann die Plausibilität von Design-Signalen erhöhen oder auch verringern. In der Frage nach der Entstehung des Linsenauges sind wir von Darwin bis heute jedoch nicht entscheidend weitergekommen. Die Entstehungsfrage stellt sich nur in anderer Form als noch vor 150 Jahren.
Das IC-Argument ist zwar nur im biochemischen Bereich scharf anwendbar, weil die Systeme dort vergleichsweise übersichtlich sind und es leichter als im Makro-Bereich möglich ist, nicht mehr verkleinerbare Schritte von einem funktionsfähigen Zustand zum nächsten anzugeben. Aber auch im Makrobereich drängt sich dieses Argument auf. Eine klare Analyse wird hier jedoch durch die Komplexität des Organs und die Begrenztheit des Wissens (noch) verhindert. Ob mehr Wissen Hinweise auf evolutionäre Mechanismen bringt oder den intuitiven Eindruck der irreduziblen Komplexität bestätigt, wird sich zeigen müssen. Forschung ist angesagt – im evolutionstheoretischen Deutungsrahmen gleichermaßen wie im Rahmen des ID-Ansatzes. Letzterer kann zudem Forschung besonders dann anregen, wenn Organe fehlkonstruiert oder funktionslos erscheinen, da eine primäre Funktionslosigkeit oder offenkundige Fehlkonstruktionen bei den Lebewesen nicht erwartet werden.
|
Anmerkung
1 Es gibt zwar Larven von Würfelquallen (Tripedalia cystophora), die Lichtsinneszellen besitzen, aber keine Verbindung zu Nervenzellen haben. Gleichzeitig ist jedoch ein Cilium in diese Zellen integriert,welches wie ein kleiner Motor die Larven vorantreiben kann (Nordström et al. 2003). In diesem Fall ist also die Eingabeeinheit (Lichtsinn) mit der Ausgabeeinheit (Motor) in einer Zelle verwirklicht. Aber auch hier wird das eingehende Lichtsignal nicht einfach nur empfangen, sondern weiterverarbeitet und in diesem Fall letztlich in eine Bewegung umgesetzt.
|
Literatur
- Arendt D (2003)
- Evolution of eyes and photoreceptor cell types. Int. J. Dev. Biol. 47, 563-571.
- Ayoub G (1997)
- Ist das Wirbeltierauge suboptimal? Stud. Int. J. 4, 77-79. (Amerikanisches Original im Internet: www.arn.org/docs/odesign/od171/retina171.htm)
- Behe MJ (1996a)
- Darwin’s Black Box: the Biochemical Challenge to Evolution. New York.
- Behe M (1996b)
- Evidence for Intelligent Design from Biochemistry. www.ac18.org/research/Origins/Michael%20J_%20Behe%20-%20Evidence.htm. (Zugriff 13. 1. 2006)
- Darwin C (1968 [1859])
- The origin of Species. Penguin Books, Harmondsworth.
- Dawkins R (1986)
- The Blind Watchmaker: Why the evidence of evolution reveals a universe without design. New York.
- Dennett D (2005)
- Intelligent Design. Wo bleibt die Wissenschaft? Spektr. Wiss. 10/2005, S. 110-113.
- Denton M (1999)
- The inverted Retina: Maladaptation or Pre-adaptation? Origins & Design 19(2), 14-17. (www.arn.org/docs/odesign/od192/invertedretina192.htm; Zugriff 13. 1. 2006)
- Drews U (1993)
- Taschenatlas der Embryologie. NewYork
- Fioroni P (1999)
- Allgemeine und vergleichende Embryologie der Tiere. Berlin
- Gehring WJ (2002)
- The genetic control of eye development and its implications for the evolution of the various eye types. Int. J. Dev. Biol. 46, 65-73.
- Gehring WJ (2005)
- New perspectives on eye development and the evolution of exes and photoreceptors. J. Hered. 96, 171-184.
- Gehring WJ & Ikeo K (1999)
- Pax 6 mastering eye morphogenesis and eye evolution. Trends Genet. 15, 371-377.
- Gutmann WF & Peters DS (1973)
- Konstruktion und Selektion: Argumente gegen einen morphologisch verkürzten Selektionismus. Acta Biotheoretica 22, 151-180.
- Halder G, Callaerts P & Gehring WJ (1995)
- Induction of ectopic eyes by targeted expression of the eyeless gene in Drosophila. Science 267, 1788-1792.
- Hansen TF (2003)
- Is modularity necessary for evolvability? Remarks on the relationship between pleiotropy and evolvability. Biosystems 69, 83-94.
- Hewitt AT & Adler R (1994)
- The retinal pigment epithelium and interphotoreceptor matrix: Structure and specialized functions. In: Ryan SJ (ed) Retina, 2nd ed., Vol. 1: Basic Science & Inherited Retinal Disease. St. Louis: Mosby, pp. 58-71.
- Isau R (2005)
- Das Unvollkommenheitsargument – Hat Gott gepfuscht? www.isau.de/id/unvollkommenheit.html (Zugriff 13. 1. 2006)
- Jones S (2005)
- Gott pfuscht auch. Warum Intelligent Design religiös motivierter Unfug ist. Die ZEIT 33/2005.
- Junker R (2002)
- Ähnlichkeiten, Rudimente, Atavismen. Design-Fehler oder Design-Signale? Holzgerlingen.
- Junker R (2005a)
- Irreduzible Komplexität. www.genesisnet. info/schoepfung_evolution/p1624.php.
- Junker R (2005b)
- Das Argument der Unvollkommenheit. www.genesisnet.info/schoepfung_evolution/p1641. php.
- Lönnig WE (1989)
- Auge widerlegt Zufalls-Evolution. Köln. (Internet: vor allem: www.weloennig.de/AuIIMoI.html; Inhaltsverzeichnis der kompletten Arbeit: www. weloennig.de/AuIn.html)
- Nesse RM & Williams GC (1997)
- Warum wir krank werden. Die Antworten der Evolutionsmedizin. München.
- Nilsson D & Pelger S (1994)
- A pessimistic estimate of the time required for an eye to evolve. Proc. R. Soc. Lond. B 256, 53-58.
- Neuhaus K (1997)
- Ist das Tintenfischauge „besser“ als das Wirbeltierauge? Stud. Int. J. 4, 79-81.
- Neuhaus K (2002)
- Gene tinkerung: Kann in komplexe biologische Systeme neue Information eingeflickt werden? Stud. Int. J. 9, 59-66.
- Neuhaus K & Ullrich H (2000)
- Das Wirbeltierauge – Ein Konstruktionsfehler ohne funktionellen Sinn? Stud. Int. J. 7, 3-11.
- Nordström K, Wallén R, Seymour J & Nilsson D (2003)
- A simple visual system without neurons in jellyfish larvae. Proc. R.Soc. Lond. B 270, 2349-2354.
- Rechenberg I (1994)
- Evolutionstrategie ’94. Stuttgart.
- Salvini-Plawen L v & Mayr E (1977)
- On the evolution of photoreceptors and eyes. In: Hecht MK, Steere WC & Wallace B (eds) Evolutionary Biology. Vol 10, New York and London, pp. 207-263.
- Scherer S (1995)
- Höherentwicklung bei Bakterien: Ist ein molekularer Mechanismus bekannt? In: Mey J, Schmidt R & Zibulla S (Hg) Streitfall Evolution. Stuttgart.
- Scherer S (1996)
- Entstehung der Photosynthese. Grenzen molekularer Evolution bei Bakterien? Neuhausen-Stuttgart.
- Shimeld SM, Purkiss AG, Dirks RPH, Bateman OA, Slingsby C & Lubsen NH (2005)
- Urochordate bg-Crystallin and the Evolutionary Origin of the Vertebrate Eye Lens. Curr. Biol. 15, 1684-1689.
|
|  |
