 |
|
von Reinhard Junker
Studium Integrale Journal
17. Jahrgang / Heft 1 - Mai 2010
Seite 21 - 28
|
 |
Zusammenfassung: Schildkröten haben den ungewöhnlichsten Bauplan unter den Wirbeltieren. Er ist so verschieden von anderen Tiergruppen, dass über die taxonomische* Zuordnung keine eindeutige Aussage möglich ist. Nachdem morphologische* Merkmale eher Verwandtschaftsbeziehungen mit phylogenetisch* alten Gruppen unterstützten, wiesen neuere molekularbiologische Untersuchungen ab Ende der 1990er Jahre in eine neue Richtung, nämlich einer Verwandtschaft mit diapsiden Formen, die als abgeleitet gelten. Morphologische und molekulare Analysen passen nicht zusammen.
Über die Entstehung des hervorstechendsten Merkmals, den Panzer, werden unterschiedliche Hypothesen vertreten. Nach der Transformationshypothese entstand der Panzer allmählich aus Hautknochen durch Fusion mit den Rippen und Wirbelfortsätzen unter der Wirkung der natürlichen Selektion. Nach der Emergenzhypothese ist der Panzer dagegen unabhängig von Anpassungsprozessen durch Neuverschaltungen von Steuergenen und Entwicklungsmodulen, also durch Veränderungen in der ontogenetischen Entwicklung entstanden. Eine besondere Rolle spielt nach dieser Hypothese eine nur in der Ontogenese* der Schildkröten vorkommende Aufwölbung aus Ektoderm und Mesoderm, die sich oberhalb der Extremitätenknospe in Längsrichtung auf der Körperflanke bildet, die Carapaxfalte (carapacial ridge, CR). Beiden Hypothesen stehen schwerwiegende Probleme entgegen. Das Für und Wider der beiden Hypothesen wird erläutert. Die Fossilüberlieferung der ältesten Schildkröten und eine kritische Bewertung der Befunde sind in einem zweiten Teil dieses Artikels vorgesehen, der in der nächsten Ausgabe dieses Journals veröffentlicht werden soll.
|  |
|
Besonderheiten des Schildkröten-Bauplans
 |
 |
| Abb. 1: Links: Typischer Aufbau des Rückenpanzers (Carapax) von Schildkröten (GNU-Lizenz für freie Dokumentation). Rechts: Sternschildkröte, Geochelone elegans, Familie Testudinidae. (Foto: Joachim Neumann, fotolia.com) |
|
Die Schildkröten besitzen den ungewöhnlichsten Bauplan unter den Reptilien. Mit ihrem zweiteiligen Panzer aus Carapax (Rückenpanzer) und Plastron (Bauchpanzer), die seitlich durch sogenannte „Brücken“ verwachsen sind, sind sie unverkennbar und deutlich verschieden von allen anderen Organismengruppen (Abb. 1). Aber nicht nur der Panzer ist einzigartig; auch viele andere Körperteile weisen Besonderheiten auf. So ist Atmung durch Bewegung des Brustkorbs wegen des starren Panzers nicht möglich, weshalb die Schildkröten ganz neue spezielle Atemtechniken und dafür besondere Muskulatur benötigen; dabei werden auch Bewegungen der Vordergliedmaßen eingesetzt (beschrieben z. B. unter http://www.monta-n.net/sk/atem.html). Ungewöhnlich ist auch die Lage des Schulterblatts; es befindet sich innerhalb des durch die Rippen gebildeten Brustkorbs – eine charakteristische Besonderheit des Schildkrötenskeletts (Abb. 2). Aufgrund dieser ungewöhnlichen Lage sind die Schildkröten die einzigen Wirbeltiere, bei denen die Beine unterhalb der Rippen gelegen sind (Gilbert et al. 2008, 2). Die Veränderungen des Skelettbaus korrelieren auch mit größeren Änderungen im Bau des Schädels, des Halses, der Muskeln der Körperachse, der Extremitäten und ihrer Gürtel und des Kopulationsapparats (Gilbert et al. 2001, 47; Nagashima et al. 2005, 149, 150; Nagashima et al. 2009).
Der Rückenpanzer besteht aus Hautknochen, die mit verbreiterten Rippen und Dornfortsätzen der Rückenwirbel verwachsen sind. Der Bauchpanzer ist vorne mit Teilen des Schultergürtels verschmolzen. Über der Knochenlage der Hautknochen befindet sich eine dünne, aber reichlich mit Blutgefäßen und Nerven versorgte Hautschicht. Darüber folgen Hornschilder, Gebilde der Oberhaut, die ähnlich wie die Knochenplatten angeordnet sind. Der Panzer fungiert in verschiedenen Arten als pH-Puffer, Reservoir für Wasser, Fett und Abfall sowie als Ort der Blutbildung (Gilbert et al. 2008, 1f.). Es gibt viele Variationen des Panzerbauplans, die hier nicht beschrieben werden sollen (siehe dazu http://www.monta-n.net/sk/bewegung.html).
Der Schädel ist anapsid gebaut, d. h. er besitzt keine Schläfenfenster (s. u.). Heutige Arten besitzen keine Zähne, ihre Kieferknochen sind mit scharfen Hornschneiden bedeckt.
Gilbert et al. (2001, 47) stellen zur Besonderheit des Schildkrötenbauplans fest: „Insgesamt enthält der Panzer über 50 Hautknochen, die es in keiner anderen Wirbeltierordnung gibt, und die Ausbildung dieser Knochenumhüllung erforderte umfangreiche Veränderungen des Vierfüßer-Bauplans. ... Der Hals, Schädel und Kopulationsapparat sind ebenfalls stark verändert.“
|
abgeleitetes Merkmal: Merkmal, das als „höherentwickelt“ eingestuft wird. Amnioten: Landwirbeltiere, deren Embryonen sich in einer mit Fruchtwasser gefüllten Amnionhöhle entwickeln. anzestral: urtümlich, ursprünglich. Expression, exprimieren: Ablesung und Nutzung der auf einem Gen niedergelegten Information. Konvergenz: gleichartige Entwicklung ähnlicher Strukturen und Funktionen einzelner Organe nicht abstammungsmäßig verwandter Organismen. Morphologie: Lehre vom Bau und der Gestalt der Organismen. Ontogenese: Individualentwicklung von der befruchteten Eizelle an. orthologe Gene: Gene verschiedener Arten, die auf ein gemeinsames Vorläufergen zurückgeführt werden können. Phylogenese: Stammesgeschichte. Schwestergruppen: Zwei Taxa (Gruppen), die auf eine nur ihnen gemeinsame Stammart zurückgeführt werden können. Taxonomie: biologische Arbeitsrichtung, die die Mannigfaltigkeit der Organismen beschreibt, benennt und ordnet. Wnt-Signalweg: Einer der Wege, über die Signale weitergeleitet werden, durch die Zellen auf äußere Signale reagieren können.
|
|
|
Systematische Stellung und frühe Fossilien
 |
| Abb. 2: Bei allen Landwirbeltieren befindet sich das Schulterblatt (Scapula) außerhalb des Brustkorbs, nur bei den Schildkröten ist es innerhalb der Rippen gelegen. (Nach scienceblogs.com) |
|
Die Einzigartigkeit des Bauplans wird auch daran deutlich, dass die systematische Stellung der Schildkröten schwer zu bestimmen ist. Der Grund dafür ist, dass nur wenige Merkmale Verbindungen zu anderen Amnioten*-Gruppen ermöglichen; es gibt zahlreiche Merkmalswidersprüche und Konvergenzen* (Zardoya & Meyer 2001, 193; Lee 1994, 63; Lee 2001; Rieppel 2000, 209). „Es ist kein Zufall, dass mehr als zehn verschiedene Gruppen früher Tetrapoden (Vierbeiner) als mögliche Vorfahren der Schildkröten identifiziert wurden“ (Cherepanov 1997, 155). Heutige Schildkröten sind einerseits stark abgeleitete* Reptilien, sie besitzen aber auch zahlreiche ursprüngliche (anzestrale*) Amnioten-Merkmale (Zardoya & Meyer 2001, 194). Sie sind somit auch in taxonomischer* Hinsicht markant als eigenständige, für sich stehende Gruppe erkennbar.
Bis vor wenigen Jahren zeigte sich dies auch deutlich in der fossilen Dokumentation. Schildkröten schienen von Beginn ihrer Fossilüberlieferung an ihren typischen Bauplan zu besitzen (Gilbert et al. 2008), wenn auch die bis vor kurzem ältesten bekannten Gattungen Proganochelys und Proterochersis eine Reihe sogenannter Primitivmerkmale aufwiesen, so im Bau des Schädels, durch den Besitz von Gaumenzähnen oder durch den Besitz von Stacheln am Hals und am Schwanz (Pritschard 2008, 47f.; Benton 2007, 245ff.). Der Carapax von Proganochelys war jedoch im Wesentlichen gebaut wie der heutiger Schildkröten und das Plastron nahezu identisch mit dem vieler moderner Halswender-Schildkröten (Pritschard 2008, 46f.).
Im Jahr 2008 wurden dann jedoch Funde beschrieben, die als Übergangsformen interpretiert wurden. Es handelt sich dabei um die Gattungen Odontochelys und Chinlechelys. Wir werden uns im zweiten Teil dieses Artikels in der nächsten Ausgabe mit diesen neuen Fossilfunden beschäftigen.
 |
| Abb. 3: Verschiedene Typen des Schläfenfensters bei Reptilien. Der Typ des Schläfenfensters dient zur Klassifikation. (Nach Romer & Parsons 1991) |
|
Anapsid oder synapsid? Lange Zeit galten die Schildkröten als die einzigen Überlebenden unter den anapsiden Reptilien; diese besitzen kein Schläfenfenster im Schädel (vgl. Abb. 3). Damit würden sie zu den ursprünglichsten Amnioten gehören. Von verschiedenen Autoren wurden sie aufgrund morphologischer* Merkmale unterschiedlich taxonomisch eingeordnet (Rieppel 2000; 2008, 346; Laurin & Reisz 1995, 168f.). Einige Autoren stellten sie jedoch wegen auffälliger Gemeinsamkeiten im Beckengürtel und den Hinterbeinen mit den Lepidosauriern trotz fehlendem Schläfenfenster zu den Diapsiden (vgl. Abb. 4). Bis Mitte der 1990er Jahre schien sich ein Konsens einzustellen, dass die Schildkröten zu den Parareptilien zu stellen seien (vgl. Abb. 4, 5), als mutmaßliche Vorläufergruppe galten die Procolophoniden oder die Pareiasaurier (Lee 1993; 1994; 1996; 1997; 2001; Laurin & Reisz 1995; Benton 2007, 245; Rieppel 2000; 2008), jedenfalls konnte man auf einige Merkmalsübereinstimmungen wie einen steifen Panzer und einen kurzen Körper sowie auf einige Ähnlichkeiten im Schädel, Wirbeln, Rippen, Gürtel und der Gliedmaßen verweisen (Laurin & Reisz 1995, 168).
Neuere morphologische und vor allem molekulare Studien haben jedoch zu einer radikalen Neubewertung der Verwandtschaftsverhältnisse geführt, wonach die Schildkröten zu den als höherentwickelt geltenden diapsiden Formen (mit zwei Schläfenfenstern) zu rechnen sind (Cao et al. 2000; Rieppel & De Braga 1996; Zardoya & Meyer 1998; 2001; Wilkinson et al. 1997; Hedges & Poling 1999; Rest et al. 2003; Iwabe et al. 2005; Hill 2005). Nach neuerer Sicht gilt das Fehlen von Schläfenfenstern folglich als sekundär, das heißt die Schläfenfenster sind wieder verlorengegangen. Molekularen Studien zufolge sind die Archosaurier (Krokodile und Vögel) die heute lebende Schwestergruppe* der Schildkröten, während morphologische Daten Lepidosaurier (Brückenechsen, Eidechsen und Schlangen) als nächste Verwandte nahelegen (Zardoya & Meyer 2001, 193). Aber auch verschiedene molekulare Studien führten nicht zu einheitlichen Ergebnissen (Zardoya & Meyer 2001, 194, Rieppel 2008, 348; vgl. Abb. 5). Wie in vielen anderen Fällen bestehen deutliche Merkmalswidersprüche zwischen molekularen Daten und morphologischen Befunden (vgl. Richter & Sudhaus 2004; Valentine 2004, 32, 148) – entgegen oftmaliger Behauptungen einer guten Passung.
 |
Wie in vielen anderen Fällen bestehen deutliche Merkmalswidersprüche
zwischen molekularen Daten und
morphologischen Befunden. |
 |
|
Mit der Neuklassifizierung und den damit einhergehenden neuen Vorstellungen zur Phylogenese* müssen die bislang als Homologien interpretierten Merkmalsübereinstimmungen zwischen den Pareiasauriern und frühen Schildkrötengattungen wie Proganochelys als Konvergenzen neu interpretiert werden (vgl. Laurin & Reisz 1995, 205f). Hier wird beispielhaft deutlich, dass Merkmalsübereinstimmungen an sich kein sicherer Führer für Verwandtschaftsverhältnisse sein können, sondern erst im Rahmen einer phylogenetischen* Hypothese entsprechend interpretiert werden. Wegen der großen Bauplanunterschiede sind Vergleiche zwischen den Schildkröten und anderen Tiergruppen und daher der Nachweis von Homologien oft schwierig (Rieppel 2008, 345).
Hypothesen zur Panzer-Entstehung
Bis vor kurzem konnte man bei Überlegungen zur Entstehung des Schildkrötenpanzers kaum auf Fossilfunde zurückgreifen. Aber auch ohne Fossilfunde stellte man Überlegungen an, wie der besondere Bau der Schildkröten entstanden sein könnte. Als ein Schlüssel zur Erklärung wurden und werden ontogenetische* Befunde angesehen, und neuerdings kamen auch Erkenntnisse in der Genetik hinzu, die helfen sollen, die Entstehung des Schildkrötenbauplans zu verstehen. Darauf soll im Folgenden eingegangen werden. Im zweiten Teil des Artikel werden dann die neuen Fossilfunde vorgestellt und im Rahmen bisheriger Entstehungshypothesen bewertet.
Unter den Kennzeichnungen „transformistisch“ und „emergentistisch“ beschreibt Rieppel (2009) zwei konkurrierende Hypothesen zur Entstehung der Schildkröten wie folgt:
Nach der transformistischen Sicht entstand der Panzer aus Hautknochen unter der Wirkung der natürlichen Selektion. Hautknochen gibt es bei vielen Arten, sie entstehen in tieferen Lagen der Haut. Bei den Schildkröten kam es nach dieser Hypothese zu einer Fusion von Hautknochen mit den Rippen und Wirbelfortsätzen.
Nach der emergentistischen Hypothese ist der Panzer dagegen durch Veränderungen in der ontogenetischen Entwicklung entstanden. Unabhängig von den Anpassungsprozessen, die durch die natürliche Selektion ausgelöst werden, bildete sich durch Neuverschaltungen von Steuergenen eine bisher nicht vorhandene Struktur. Man beachte hier die Verwendung des Begriffes „Emergenz“ („Auftauchen“). Damit ist eine aus den Vorbedingungen nicht ableitbare Neuheit zu verstehen; das kann man als „Überraschungseffekt“ bezeichnen. Dieses Verständnis ist typisch für den sogenannten Evo-Devo-Ansatz, wonach ein zufällig passendes, aber andersartiges Verschalten vorhandener Steuergene zu neuen Strukturen führen soll (vgl. Junker 2009).
Inwieweit die beiden Szenarien realistisch sind, wird weiter unten diskutiert. Hier soll zunächst im Rahmen evolutionstheoretischer Vorstellungen beurteilt werden, welche der beiden konkurrierenden Vorstellungen besser zu den vergleichend-biologischen, ontogenetischen und paläontologischen Daten passt. Nach dieser „innerevolutionstheoretischen“ Abwägung soll die „externe Konsistenz“ beurteilt werden.
|
|
Zur Ontogenese des Panzers und die Carapaxfalte
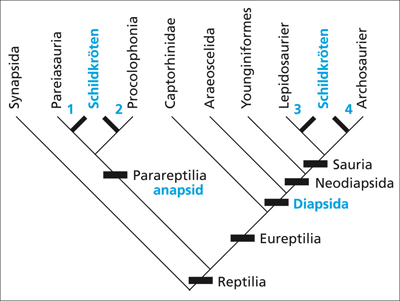 |
| Abb. 4: Bis etwa Mitte der 1990er Jahre wurden die Schildkröten wegen ihres anapsiden Schädelbaus (vgl. Abb. 3) als Angehörige primitiver Reptilien betrachtet und zu den Parareptilia gestellt (Position 1 oder 2). Nach molekularen Studien müssen die Schildkröten jedoch zu den abgeleiteten Diapsiden gestellt werden, wobei die genaue Position unsicher ist (3 oder 4). (Nach Rieppel 2008, verändert) |
|
Die Bildung des Schildkrötenpanzers hängt ontogenetisch eng mit der Ausbildung der „Carapaxfalte“ („carapacial ridge“, CR) zusammen, einer Aufwölbung aus Ektoderm und Mesoderm, die sich oberhalb der Extremitätenknospe in Längsrichtung auf der Körperflanke bildet (Abb. 6). Die CR ist eine einzigartige Struktur bei Amnioten (Nagashima et al. 2007) und soll zu einer neuen Epithel-Mesenchym-Interaktion geführt haben, die das Rippenwachstum beeinflusst (Burke 1989, 365; Burke 1991; Gilbert et al. 2001, 47; Nagashima et al. 2007). Die ersten ontogenetischen Abfolgen – Bildung der Körperachse, der Somiten (Ursegmente) und der Extremitätenknospen – sind bei den Schildkröten zunächst noch identisch mit denen anderer Tetrapoden (Vierbeiner). Erst wenn die Körperwand gebildet wird, weicht die Ontogenese deutlich bei der Entwicklung der Haut, der Wirbel und der Rippen ab (Burke 1989, 372; Rieppel 2001, 991; Kuraku et al. 2005). Durch die Wechselwirkung mit der CR biegen die Rippen in eine andere Position ab, nämlich zur Seite. Dadurch positioniert sich der Schultergürtel innerhalb des Brustkorbs (Abb. 6). Die Rolle der CR zeigt sich darin, dass nach ihrer experimentellen Entfernung die Rippenbildung wie bei anderen Wirbeltieren verläuft (Burke 1991; vgl. Robert 2002, 602f.; Cebra-Thomas 2005, 559). „Der CR ist für die Umlenkung der Zellwanderung verantwortlich und für die Ausrichtung der Schildkröten-Entwicklung entlang eines neuen Wegs“ (Robert 2002, 603).
Experimente von Nagashima et al. (2007) zeigten allerdings, dass die CR nicht für die besondere Lage der Rippen, sondern nur für deren fächerförmige Ausprägung verantwortlich ist. Möglicherweise gilt dies aber nur für die von Nagashima et al. untersuchte Art; die Methode der CR-Inaktivierung verlief bei ihren Versuchen anders als bei Burke (1989). Die Autoren halten es auch für möglich, dass der Einfluss der CR auf das Wachstum der Rippen in einem früheren Stadium wirksam ist (Nagashima et al. 2007, 2225).
Die CR kann jedenfalls als eine Art Schlüssel-Organanlage betrachtet werden, die eine notwendige Voraussetzung für die Bildung des ungewöhnlichen Schildkrötenbauplans darstellt. Nagashima et al. (2007) bezeichnen sie als eine echte neue Struktur („genuinely novel structure“), die von den Somiten abgeleitet ist.
Trotz der experimentell erforschten Zusammenhänge zwischen der Ausbildung der CR und dem Schildkrötenbauplan gelangen Nagashima et al. (2007, 2226) zum Schluss, dass weitgehend Unkenntnis über die Faktoren besteht, die diesen besonderen Bauplan bewirken: „Wir verstehen immer noch nicht die wichtigsten Faktoren, die dem Bauplan der Schildkröten zugrunde liegen, nämlich die Faktoren, die zur rückenwärtigen Verschiebung der Rippen der Schildkröten führen.“ Dies ist zu bedenken, wenn man hypothetische Betrachtungen über die evolutionären Entstehungsmechanismen anstellt.
In einer neuen Studie beschäftigen sich Nagashima et al. (2009) mit der Muskulatur, die bei der Bildung des Carapax beteiligt ist. Einige Beinmuskeln bilden im Zusammenhang mit der Bildung des Carapax spezifische Muskelansätze. Nagashima et al. (2009, 193) erklären dies durch eine Hetero-topie (räumliche Verschiebung), basierend auf Faltung und neuen Verknüpfungen. Obwohl der Panzer als evolutionäre Neuheit betrachtet werden könne, seien die muskulären Veränderungen nicht so radikal, dass sie die morphologischen Homologien der einzelnen Strukturen zerstören würden (Nagashima et al. 2009, 195). Man kann also zwar eine Homologie der Bauelemente konstatieren, aber diese gehen dann im Schildkröten-Bauplan teilweise neue Verknüpfungen ein.
|
|
Evolutionstheoretische Folgerungen
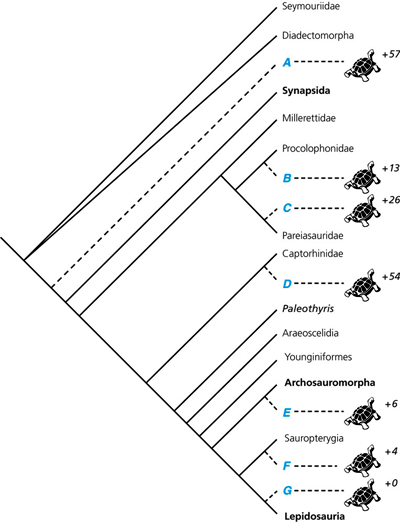 |
| Abb. 5: Detaillierter Überblick über diskutierte alternative Hypothesen phylogenetischer Positionen der Schildkröten innerhalb der Amnioten (nach Hill et al. 2005). Taxa, die auch heute lebende Arten beinhalten, sind fett dargestellt. Hill et al. nutzten einen umfangreichen Datensatz aus morphologischen und molekularen Merkmalen von 80 Arten (insgesamt 370 Merkmale), fassten die Daten früherer Studien zusammen und ergänzten diese mit weiteren Daten. Die rechts angegebenen Zahlen geben an, wieviele zusätzliche evolutionäre Schritte gegenüber der sparsamsten Hypothese erforderlich sind. |
|
Aufgrund ihrer Schlüsselrolle in der ontogenetischen Bildung des Panzers wird der Entstehung der CR auch eine Schlüsselrolle in der phylogenetischen (stammesgeschichtlichen) Entstehung des Panzers zugewiesen (Burke 1989, 365). Von besonderer Bedeutung ist dabei, dass die CR histologische (gewebliche) Ähnlichkeiten (Homologien) mit der Extremitätenknospe („apical ectodermal ridge“, AER) aufweist (Nagashima et al. 2007). Diese Ähnlichkeit motivierte die Hypothese, dass die CR und im Gefolge ihrer Entstehung der Panzer durch eine Art „Mega-Duplikation“ der Extremitätenknospe entstanden sein könnte. „Mega-Duplikation“ bedeutet, dass mehrere vernetzte Gene oder ganze Bauteile verdoppelt und neuen Aufgaben zugeführt werden.
Dies würde eine große Veränderung in der frühen Embryonalentwicklung erfordern. Rieppel (2001, 987) schreibt dazu: „Die Evolution der hochgradig abgeleiteten Anatomie der ausgewachsenen Schildkröten ist ein Paradebeispiel eines makroevolutiven Ereignisses, das durch Veränderungen in der frühen Embryonalentwicklung ausgelöst wurde. Eine frühe ontogentische Abweichung kann ein Muster morphologischer Veränderungen verursachen, das nicht mit Szenarien einer gradualistischen, schrittweisen Umbildung vereinbar ist“ (Rieppel 2001, 987). Eine schrittweise Entstehung hält Rieppel in diesem Szenario aus konstruktiven Gründen für ausgeschlossen, denn die Rippen können nur entweder unterhalb oder oberhalb des Schulterblatts lokalisiert sein (vgl. Abb. 2 und 6), daher seien die beiden Möglichkeiten ihrer Positionierung nur sprunghaft veränderbar. Die Entstehung durch eine Mega-Duplikation soll eine schnelle Evolution plausibel machen. Ähnlich argumentiert auch Burke (1989, 376): „Eine Zunahme der relativen Größe und des Einflusses des induktiven Feldes unter einer durchgängigen Hautverdickung resultierte in einer Struktur, die der Extremitätenknospe ähnelt. ... Die mechanistischen Ähnlichkeiten dieser Wechselwirkungen während der Entwicklung weisen darauf hin, dass neue Formen durch geringe Änderungen eines konservierten Sets von Entwicklungsregeln hervorgerufen werden können.“
Die Hypothese der Mega-Duplikation ist eine typische Konsequenz aus dem Evo-Devo-Ansatz, wonach geringfügige Änderungen in der Ontogenese umfangreiche Bauplanänderungen hervorrufen können. „Die Evolution des einzigartigen Umbaus der Achsen-Elemente der Schildkröten in einen Carapax resultierte nicht einfach aus einer Anfügung neuer Elemente in der späten Ontogenese.
Vielmehr erforderte sie eine umfangreiche Neuanordnung der Grundelemente des sich entwickelnden Wirbeltierskeletts“ (Burke 1989, 364f.).
Die Hypothese einer Duplikation des AER wird durch die Nutzung identischer Gene in der CR und der AER unterstützt, ihr stehen allerdings auch einige bedeutende genetische Unterschiede zwischen der CR und der AER entgegen. Darauf wird im Folgenden kurz eingegangen.
Genetische Studien. Verschiedene genetische Studien wiesen nach, dass in der CR zahlreiche Gene in einem spezifischen Muster exprimiert (gebraucht) werden, die sonst auch anderweitig in der Entwicklung genutzt werden; eine Beobachtung, die mittlerweile oft gemacht wurde. Die Mehrfachnutzung („Kooption“) derselben Gene in verschiedenen Zusammenhängen ist weit verbreitet. Kuraku et al. (2005) fanden als CR-spezifische Gene LEF-1, APCDD1, CRABP1 und Sp5, die alle ortholog* mit anderweitig vorkommenden Wirbeltiergenen sind, deren Regulation sich aber spezifisch in der Schildkrötenlinie geändert hat. Weiter gibt es Hinweise, dass der Wnt-Signalweg* die Entwicklung des Carapax auslöst und für diesen Zweck rekrutiert wurde (Kuraku et al. 2005). Ohya et al. (2005) entdeckten eine Schildkröten-spezifische Expression einiger Hox-Gene. Auch hier werten die Autoren die Befunde so, dass nicht die Hox-Proteine an sich für die Ausbildung des spezifischen Bauplans der Schildkröten verantwortlich sind, sondern ihre Regulation (Ohya et al. 2005, 116). Zur Sicherung dieses Ergebnisses seien aber weitere Studien nötig. Das Homeobox-Gen Msx1 spielt eine Rolle bei der Hautverknöcherung des Carapax; dieser Vorgang ähnelt der Verknöcherung der Hautknochen des Schädels bei Maus und Hühnchen, wo Msx1 auch beteiligt ist (Kuraku et al. 2005; vgl. Vincent et al. 2003).
Loredo et al. (2001) und Kuraku et al. (2005) fanden heraus, dass es in der Genexpression* der AER und CR wichtige Unterschiede gibt. Beim Hühnchen wird Fgf10 (fibroblast growth factor) im frühen Mesenchym der Beinanlage exprimiert, das resultierende Protein induziert seinerseits FGF8 im AER, um den Auswuchs der Extremitätenknospen zu initiieren. Im CR ist FGF8 jedoch abwesend. Die Abwesenheit von FGF8 im CR ist ein ernsthaftes Problem für die Hypothese von der Ableitung des CR durch Duplikation des AER, weil FGF8 zu den zentralen funktionalen Elementen der Extremitätenentwicklung gehört. Somit sind in der CR andere molekulare Kaskaden beteiligt, die nicht in der Ontogenese der Beine vorkommen (Kuraku et al. 2005, 3f.). Eine Kooption der kompletten Steuerungskaskade des AER im CR ist als Erklärung der CR-spezifischen Gene daher problematisch. Es müssen demzufolge weitere tiefgreifende ontogenetisch relevante Änderungen postuliert werden, die den schwer verständlichen Verlust von FGF8 kompensieren. (Einen Überblick über genetische Studien zur Carapaxfalte geben Gilbert et al. [2008, 5].)
Folgerungen für die konkurrierenden Hypothesen der Panzer-Entstehung
Die Bedeutung des CR für die Bildung des Panzers spricht unter evolutionstheoretischen Voraussetzungen wohl eher für die Emergenzhypothese Rieppels. Auch wenn die CR nicht als bloße Mega-Duplikation der AER interpretiert werden kann, ist ihr schrittweiser Aufbau (bzw. „Nachbau“) aus der AER im Sinne der Transformationshypothese – angesichts zahlreicher Gemeinsamkeiten – noch schwerer verständlich. Denn wenn Hautknochen allmählich vergrößert werden und mit den verkürzten und sich auffächernden Rippen und Wirbeln verwachsen, ist nicht zu erwarten, dass sich dabei eine CR mit Ähnlichkeiten zur AER bildet. Diese Ähnlichkeiten sehen schon eher nach einer „Kopie“ aus. Rieppel (2008, 347) ist der Auffassung, dass das gradualistische Szenario des Transformismus die morphologische Komplexität des Schildkrötenpanzers nicht erkläre, aber auch durch die Ontogenese der Schildkröten nicht unterstützt werde, die keine Anzeichen einer rückwärtigen Verschiebung des Schultergürtels erkennen lasse.
 |
Vorerst fehlt noch die Basis,
phylogenetische Hypothesen zur
Entstehung des Panzers
genauer prüfen zu können. |
 |
|
Aber auch die emergente Entstehung ist problematisch: Wenn die CR wirklich durch eine Mega-Duplikation (mit nachfolgenden weiteren Veränderungen) entstand, ist unklar, weshalb mit FGF8 ein zentrales funktionales Steuerelement ohne Konsequenzen im Verlauf der Evolution aussortiert werden konnte (s.o.). In allen Fällen bleibt die Frage nach den Mechanismen der Rekrutierung und Abstimmung der CR-spezifischen Genkaskaden offen, erst recht, wenn ein ganzer Komplex rekrutiert worden sein soll. Mit Begriffen wie „Kooption“ und „Rekrutierung“ wird jedenfalls nur ein vergleichend-biologischer Befund – nicht der evolutionäre Prozess selbst! – beschrieben, konkret die Nutzung derselben Gene in verschiedenen Zusammenhängen. Wie die Schritte zu deren zusätzlicher Verwendung in einem neuen Kontext im Einzelnen ablaufen, bleibt unbeantwortet, also wie neue Gene in neuen Zusammenhängen detailliert eingebunden werden, damit sie u. a. neue Regulationsfunktionen übernehmen können. Die bisherigen genetischen Studien (s. o.) haben gezeigt, dass allein die ontogenetischen Verhältnisse hochkompliziert sind. Nagashima et al. (2007, 2220) kommen zum Schluss: „Daher bleiben die Funktion der CR-spezifischen Gene und ihre Regulation, die den Mechanismus der Entwicklung des CR erklären könnten, rätselhaft.“ Damit aber fehlt vorerst die Basis, phylogenetische Hypothesen zur Entstehung des Panzers genauer prüfen zu können. Solange die ontogenetischen Abläufe noch „rätselhaft“ sind, kann der evolutive Werdegang erst recht nicht als geklärt betrachtet werden.
|
|
Phylogenetische Position
 |
| Abb. 6: Ungewöhnliche Lage des Schulterblatts und des Musculus serratus anterior bei Schildkröten im Vergleich zu anderen Amnioten (vgl. auch Abb. 2). Siehe rechts die Lage der Carapaxfalte (Näheres im Text). Der Musculus serrratus anterior ist der vordere gezackte Muskel, er gehört zur tiefen Rückenmuskulatur. Mit „Körperwand“ ist die seitliche Körperwand des Brustkorbes gemeint. (Nach Nagashima et al. 2009 und scienceblogs.com) |
|
Da die Schildkröten keine Schläfenfenster besitzen, lag es nahe, sie als primär anapsid einzustufen (vgl. Abb. 3). Da die anapside Schädelform als ursprünglich gilt, wurde die Schildkrötenlinie bis vor gut einem Jahrzehnt entsprechend als alt und ursprünglich angesehen. Diese Einstufung hat sich jedoch durch molekulare, aber auch neuere morphologische Untersuchungen grundlegend geändert. Darauf wurde bereits im Abschnitt „Systematische Stellung und frühe Fossilien“ hingewiesen. Die Schildkröten werden nun umgekehrt als junge Gruppe unter den Reptilien angesehen. Untersuchungen der cDNA-Sequenzen einiger Laktat-Dehydrogenasen und α-Enolasen von Mannen & Li (1999) lassen vermuten, dass die Schildkrötenlinie nach der Divergenz der Schuppenkriechtiere (Squamata) und Vögel abzweigte, womit die Schildkröten die späteste Reptilienlinie wären, die auf einen Vorfahren der Crocodilia innerhalb der letzten 200 Millionen Jahre zurückgeführt wird (Mannen & Li 1999, 144). Verschiedene Untersuchungen führten zwar nicht zu einheitlichen Ergebnissen (s. o.), aber gemeinsam ist allen, dass die Schildkröten molekularen Studien zufolge eine relativ junge Linie innerhalb der Amnioten sein dürften. Das steht in Spannung zu paläontologischen Befunden, denn es wurden Fossilfunde gemacht, die bis zu 220 Millionen Jahre alt sind (s. u.). Aus der Obertrias (älter als 200 Millionen Jahre) sind mehrere Gattungen bekannt, die verschiedenen evolutionären Linien zugeordnet werden (vgl. z. B. Gaffney 1975). Mannen & Li (1999, 147) ermittelten als Divergenzzeit für die Trennung der Alligatoren- und Schildkrötenlinie sogar nur 151,6 ± 23,7 Millionen Jahre, was eine sehr deutliche Inkonsistenz von molekularen Abschätzungen und dem Fossilbericht bedeutet. Es ist daher nicht verwunderlich, dass Scheyer & Sander (2007, 1885) feststellen, dass die phylogenetische Position der Schildkröten innerhalb der Amnioten eines der rätselhaftesten und kontroversen Probleme in der Wirbeltiersystematik sei. Dass die phylogenetische Position der Schildkröten innerhalb der Amnioten seit über einem Jahrhundert umstritten ist, vermerken auch Ohya et a. (2005, 116) und diskutieren zwei Haupt-Hypothesen, die beide nach Meinung der Wissenschaftler auf z. T. anfechtbaren Evidenzen beruhen.
Land oder Wasserschildkröten zuerst? Bis vor kurzem wurde eine Entstehung der Schildkröten im Wasser als wahrscheinlicher angesehen als eine Entstehung auf dem Land (z. B. Lucas et al. 2000, Maisch 2009). Joyce & Gauthier (2004) meldeten aufgrund der Proportionen der Extremitäten von zweien der ältesten Fossilien (Proganochelys quenstedti und Palaeochersis talampayensis) Bedenken gegen eine Entstehung im Wasser an und plädierten für eine Entstehung auf dem Land. Diese Sichtweise schien sich durch eine Untersuchung der Knochenfeinstruktur der Panzer der damals ältesten bekannten Schildkrötenfossilien aus dem süddeutschen Keuper (Obere Trias) im Vergleich mit heutigen Landschildkröten zu bestätigen (Scheyer & Sander 2007). Diese Autoren untersuchten Proganochelys quenstedti (2. Stubensandstein; Löwenstein-Formation; ca. 212,5 Millionen Jahre und unterer Knollenmergel; Trossingen-Formation; ca. 206 Millionen Jahre) und Proterochersis robusta (1. Stubensandstein; Löwenstein-Formation; ca. 214 Millionen Jahre; Fraas 1913). Nach den von Scheyer & Sander (2007) und Joyce & Gauthier (2004) vorgelegten Befunden konnten die Schildkröten nicht semiaquatisch, sondern mussten als Landtiere begonnen haben. Denn ihre Panzer waren ähnlich gebaut wie die Panzer heutiger Landschildkröten und ihre Extremitätenproportionen passen am ehesten zu Landschildkröten. Schon früh in ihrer Geschichte ist danach für die Schildkröten ein semiaquatischer und schließlich auch voll aquatischer und sogar ein sekundär terrestrischer Lebensstil dokumentiert (Scheyer & Sander 2007, 1892).
Im zweiten Teil des Artikels werden neue Fossilfunde vorgestellt und im Rahmen der konkurrierenden Panzer-Entstehungshypothesen diskutiert. Außerdem wird ein Überblick über evolutionstheoretische Fragen zur Panzer-Entstehung gegeben und es werden Möglichkeiten einer nicht-evolutionären Deutung angesprochen.
Dank: Einige hilfreiche Hinweise verdanke ich Manfred Stephan und Dr. Henrik Ullrich.
|
Literatur
- Benton MJ (2007)
- Paläontologie der Wirbeltiere. München.
- Burke AC (1989)
- Development of the Turtle Carapace: Implications for the Evolution of a Novel Bauplan. J. Morphol. 199, 363-378.
- Burke AC (1991)
- The development and evolution of the turtle body plan: inferring intrinsic aspects of the evolutionary process from experimental embryology. Amer. Zool. 31, 616-627.
- Cao X, Sorenson MD, Kumazawa Y, Mindell DP & Hasegawa M (2000)
- Phylogenetic position of turtles among amniotes: evidence from mitochondrial and nuclear genes. Gene 259, 139-148.
- Cebra-Thomas J, Tan F, Sistla S, Estes E, Bender G, Kim C, Riccio P & Gilbert SF (2005)
- How the Turtle Forms its Shell: A Paracrine Hypothesis of Carapace Formation. J. Exp. Zool. 304B, 558-569.
- Cherepanov GO (1997)
- The origin of the bony shell of turtles as a unique evolutionary model in reptiles. Russ. J. Herpetol. 4, 155-162.
- Fraas E (1913)
- Proterochersis, eine pleurodire Schildkröte aus dem Keuper. Jh. Ver. vaterländ. Nat.kd. Württ. 69, 13-30.
- Gaffney ES (1975)
- A phylogeny and classification of the higher categories of turtles. Bull. Am. Mus. Nat. Hist. 155, 387-436.
- Gilbert SF, Loredo GA, Brukmann A & Burke AC (2001)
- Morphogenesis of the turtle shell: the development of a novel structure in tetrapod evolution. Evol. Dev. 3, 47-58.
- Gilbert JF, Cebra-Thomas JA & Burke AC (2008)
- How the turtle gets its shell. In: Wyneken J, Godfrey MH & Bels V (eds) Biology of Turtles.Boca Raton: CRC Press, S. 1-16.
- Hedges SB & Poling LL (1999)
- A molecular phylogeny of reptiles. Science 283, 998-1001.
- Hill RV (2005)
- Integration of Morphological Data Sets for Phylogenetic Analysis of Amniota: The Importance of Integumentary Characters and Increased Taxonomic Sampling. Syst. Biol. 54, 530-547.
- Iwabe N, Hara Y, Kumazawa Y, Shibamoto K, Saito Y, Miyata T & Katoh K (2005)
- Sister Group Relationship of Turtles to the Bird-Crocodilian Clade Revealed by Nuclear DNA–Coded Proteins. Mol. Biol. Evol. 22, 810-813.
- Joyce WG & Gauthier JA (2004)
- Palaeoecology of Triassic stem turtles sheds new light on turtle origins. Proc. R Soc. Lond. B 271, 1-5.
- Junker R (2009)
- Evo-Devo: Schlüssel für Makroevolution? Teil 2: Wiederverwendung, Umfunktionierung und Neuprogrammierung. Stud. Int. J. 16, 17-21.
- Kuraku, S Usuda R & Kuratani S (2005)
- Comprehensive survey of carapacial ridge-specific genes in turtle implies co-option of some regulatory genes in carapace evolution. Evol. Dev. 7, 3-17.
- Laurin M & Reisz RR (1995)
- A reevaluation of early amniote phylogeny. Zool. J. Linn. Soc. 113, 165-223.
- Lee MSY (1993)
- The Origin of the Turtle Body Plan: Bridging a Famous Morphological Gap. Science 261, 1716-1720.
- Lee MSY (1994)
- The turtle’s long-lost relatives. Nat. Hist. 103, 63-65.
- Lee MSY (1996)
- Correlated progression and the origin of turtles. Nature 379, 812-815.
- Lee MSY (1997)
- Pareiasaur phylogeny and the origin of turtles. Zool. J. Linn. Soc. 120, 197-280.
- Lee MSY (2001)
- Molecules, morphology, and the monophyly of diapsid reptiles. Contr. Zool. 70, 1-22.
- Loredo GA, Brukman S et al. (2001)
- Development of an Evolutionarily Novel Structure: Fibroblast Growth Factor Expression in the Carapacial Ridge of Turtle Embryos. J. Exp. Zool. 291, 274-281.
- Lucas SG, Heckert AB & Hunt AP (2000)
- Probable turtle from the Upper Triassic of East-Central New Mexico. N. Jb. Geol. Paläont. Mh. 2000 (5), 287-300.
- Maisch M (2009)
- Trias-Schildkröten aus China und New Mexico. Nat. Rdschau 162, 199-201.
- Mannen H & Li SSL (1999)
- Molecular evidence for a clade of turtles. Mol. Phyl. Evol. 13, 144-148.
- Nagashima H, Uchida K, Yamamoto K, Kuraku S, Usuda R & Kuratani S (2005)
- Turtle-Chicken Chimera: An Experimental Approach to Understanding Evolutionary Innovation in the Turtle. Dev. Dyn. 232, 149-161.
- Nagashima H, Kuraku S, Uchida K, Ohya YK, Narita Y & Kuratani S (2007)
- On the carapacial ridge in turtle embryos: its developmental origin, function and the chelonian body plan. Development 134, 2219-2226.
- Nagashima H, Sugahara F, Takechi M, Ericsson R, Kawashima-Ohya Y, Narita Y & Kuratani S (2009)
- Evolution of the Turtle Body Plan by the Folding and Creation of New Muscle Connections. Science 325, 193-196.
- Ohya YK, Kuraku S & Kuratani S (2005)
- Hox Code in Embryos of Chinese Soft-Shelled Turtle Pelodiscus sinensis Correlates With the Evolutionary Innovation in the Turtle. J. Exp. Zool. 304B, 107-118.
- Pritchard PCH (2008)
- Evolution and Structure of the Turtle Shell. In: Wyneken J, Godfrey MH & Bels V (eds) Biology of Turtles. Boca Raton: CRC Press, S. 45-83.
- Rest JS, Ast JC, Austin CA, Waddell PJ, Tibbetts EA, Hay JH & Mindell DP (2003)
- Molecular systematics of primary reptilian lineages and the tuatara mitochondrial genome. Mol. Phyl. Evol. 29, 289–297.
- Richter S & Sudhaus W (2004, eds)
- Kontroversen in der Phylogenetischen Systematik der Metazoa. Sitzungsberichte der Gesellschaft Naturforschender Freunde zu Berlin N. F. 43, 1-221.
- Rieppel O (2000)
- Turtles as diapsid reptiles. Zool. Scripta 29, 199-212.
- Rieppel O (2001)
- Turtles as hopeful monsters. BioEssays 23, 987-991.
- Rieppel O (2008)
- The Relationships of Turtles within Amniotes. In: Wyneken J, Godfrey MH & Bels V (eds) Biology of Turtles. Boca Raton: CRC Press, S. 345-353.
- Rieppel O (2009)
- How did the turtle get its shell? Science 325, 154-155.
- Rieppel O & de Braga M (1996)
- Turtles as diapsid reptiles. Nature 384, 453-455.
- Robert JS (2002)
- How developmental is evolutionary developmental biology? Biol. Philos. 17, 591-611
- Romer AS & Parsons TS (1991)
- Vergleichende Anatomie der Wirbeltiere. Hamburg.
- Scheyer TM & Sander PM (2007)
- Shell bone histology indicates terrestrial palaeoecology of basal turtles. Proc. R. Soc.274B, 1885-1893. (deutsche Übersetzung des Abstracts unter http://www.schildkroeten-im-fokus.de/wif/scheyer01.html)
- Valentine JW (2004)
- On the origin of phyla. Chicago.
- Vincent C, Bontoux M, Le Douarin NM, Pieau C & Monsoro-Burq AH (2003)
- Msx genes are expressed in the carapacial ridge of turtle shell: a study of the European pond turtle, Emys orbicularis. Dev. Genes Evol. 213, 464-469.
- Wilkinson M, Thorley J & Benton MJ (1997)
- Uncertain turtle relationships. Nature 387, 466.
- Zardoya R & Meyer A (1998)
- Complete mitochondrial genome suggests diapsid affinities of turtles. Proc. Natl. Acad. Sci USA 95, 14226-14231.
- Zardoya R & Meyer A (2001)
- The evolutionary position of turtles revisited. Naturwissenschaften 88, 193-200.
|
|  |
