 |
Fossile Abfolgen:
Evolutionär oder ökologisch bedingt? von Reinhard Junker & Manfred Stephan
Studium Integrale Journal
9. Jahrgang / Heft 2 - Oktober 2002
Seite 85 - 87
|
|
Aus der Fossilüberlieferung sind unzählige Beispiele dafür bekannt, daß sich an Ort und Stelle von Schicht zu Schicht Fossilgruppen in ihrem Aussehen verändern. Ein typisches Beispiel ist in Abb. 1 wiedergegeben. Solche Fälle bewegen sich im mikroevolutiven Rahmen, wobei dieser Rahmen durch den Vergleich der Formenvielfalt innerhalb heutiger Grundtypen abgesteckt wird. Es stellt sich die Frage, wodurch diese Formenunterschiede hervorgerufen werden. Können sie als Belege evolutiver Abwandlungen interpretiert werden? Dies ist keineswegs einfach zu entscheiden, stellen SAMADI et al. (2000) fest. Die Interpretation paläontologischer Daten sei schwierig, weil die genetischen Grundlagen der beobachteten morphologischen Variation (also die Unterschiede in der äußeren Erscheinungsform) allgemein nicht bekannt seien. Es sei kaum möglich, zwischen verschiedenen Quellen morphologischer Unterschiede zu unterscheiden. Diese können außer auf Veränderungen des Erbguts, die allein für evolutionäre Interpretationen von Bedeutung sind, als auch auf folgende Faktoren zurückgeführt werden:
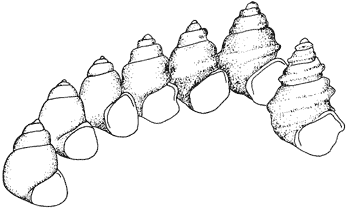 |
| Abb. 1: An derselben Lokalität zeitlich aufeinanderfolgende Formen der Süßwasserschnecke Viviparus brevis im Pleistozän der Insel Kos (Griechanland). Nach WILLMANN (1985) |
|
- Phänotypische Plastizität. Lebewesen sind in mehr oder weniger großem Umfang in der Lage, in Anpassung an Schwankungen von Umweltfaktoren (z. B. Salzgehalt des Wassers) ihr Erscheinungsbild zu ändern. Dabei bleibt der Genotyp (die genetische Ausstattung) unverändert. SAMADI et al. (2000, 497) weisen darauf hin, daß z. B. die Schalenform bei Gastropoden (Schnecken) ein „notorisch plastisches Merkmal“ ist.
- Sexualdimorphismus. Männchen und Weibchen sind häufig unterschiedlich gestaltet.
- Genetische Variation innerhalb der Arten. Populationen weisen eine natürliche genetische Vielfalt auf.
- Genetische Unterschiede zwischen verschiedenen Arten. Die beobachteten Unterschiede können auf die Existenz zweier verschiedener Arten zurückgeführt werden. Eine Art mag neu in das Überlieferungsgebiet eingewandert sein und so zu Änderungen der fossilen Überlieferung beitragen.
|
|
Beispiele
Beispiele. In einer Studie über die Fossilabfolgen der Süßwasserschnecke Melanoides Anfang der achtziger Jahre hatte WILLIAMSON (1981a; b) deren Variation in plio- und pleistozänen Schichten (Turkana-Serie, Nord-Kenia, 2,6-1,5 Ma) untersucht. Dabei zeigte sich, daß in 13 Linien keine Variation zu beobachten war außer bei drei Ereignissen, bei denen sich eine deutliche und schnelle Änderung einstellte. Jedem Ereignis ging ein kurzer Anstieg der phänotypischen Variabilität voraus, dem dann eine abrupte Rückkehr zur früher verwirklichten Morphologie folgte. Das entspricht den Vorstellungen des sog. „punctuated equilibrium“, wonach normalerweise keine nennenswerten Änderungen in evolutionären Linien erfolgen und nur kurzzeitig dieses Gleichgewicht unterbrochen wird. Als mögliche Ursachen für diese Unterbrechungen führen SAMADI et al. (2000) ein Zusammenbruch der genetischen Homöostase (Gleichgewicht) in geographisch isolierten Populationen (z. B. durch ein Gründerereignis), Einwanderung von anderen Populationen oder Umweltveränderungen an.
| Phänotypisch: das sichtbare Erscheinungsbild betreffend. |
| Plastizität: Fähigkeit, die Gestalt unter verschiedenen Umwelteinflüssen zu ändern und diese neue Form beizubehalten. |
| Population: Fortpflanzungsgemeinschaft von Individuen einer Art. |
|
SAMADI et al. (2000) untersuchten die genetische Basis der Variabilität heute lebender Melanoides tuberculata-Populationen, um eine bessere Datenbasis für die Interpretation der Variation bei Fossilien zu gewinnen und um die oben erwähnten Ergebnisse von Williamson an den Schnecken der Turkana-Serie neu zu interpretieren. Dabei bestätigte sich, daß es bei den untersuchten Schnecken mehrere Quellen für Variabilität gibt. Durch sporadisches Vorkommen von Männchen unter den sich parthenogenetisch (durch Jungfernzeugung) fortpflanzenden Melanoides-Schnecken kann die Variabilität vorübergehend gesteigert werden. Durch Umweltschwankungen konnte eine phänotypische Plastizität hervorgerufen werden, die die genetisch bedingten Unterschiede übertrifft. In Martinique war darüber hinaus zuvor schon beobachtet worden, daß es durch Einwanderung neuer Morphen (Gestalten) oder nah verwandter Arten in kurzer Zeit einen Wechsel in der Schalenform gab (POINTIER et al. 1998). SAMADI et al. (2000, 500) stellen fest: Die Phasen einer Stasis (Zeiten ohne Veränderungen) können durch stabile Umweltbedingungen erklärt werden, während Umweltveränderungen als Auslöser für Gestaltveränderungen auf der Basis phänotyopischer Plastizität gelten können.
Gestaltabwandlungen von Süßwasserschnecken-Gehäusen in der Schichtenfolge spielten schon zu DARWINs Zeiten eine nicht unbedeutende Rolle. F. HILGENDORF vertrat und verteidigte zwischen 1866 und 1879 zuerst die Ansicht, daß die Abfolge der miozänen (jungtertiären) Schnecken (Gyraulus) von Steinheim am Albuch (Schwäbische Alb) eine evolutionäre Reihe darstelle. In der 6. Auflage (1872) seines zuerst 1859 erschienen Werkes On the Origin of Species verwies DARWIN auf HILGENDORFs Schneckenstammbaum als ein Beleg für seine Theorie (446). Die spätere Erforschung der Steinheimer Schnecken schwankte auch hier zwischen ökologischen und genetischen bzw. evolutiven Positionen (ADAM 1980, 16-23; vgl. HEIZMANN & REIFF 1998, 170f.).
|
|
Schlußfolgerung
Schlußfolgerung. Aufgrund der oben dargestellten Situation ist es bei Fossilien nicht möglich, zwischen solchen Unterschieden, die evolutionär signifikant sind, und solchen, bei denen das nicht der Fall ist, zu unterscheiden. Fossile Abfolgen innerhalb von Grundtypen können daher nicht ohne Weiteres evolutionär interpretiert werden.
|
Literatur
- ADAM KD (1980)
- Das Steinheimer Becken – eine Fundstätte von Weltgeltung. Monumenta geologica et palaeontologica. Steinheim am Albuch.
- DARWIN C (1872)
- On the Origin of Species (6. Aufl.). London. Angeführt nach der deutschen Übersetzung von C. NEUMANN. Stuttgart 1963.
- HEIZMANN EPJ & REIFF W (1998)
- Aus der Katastrophe geboren – Das Steinheimer Becken. In: HEIZMANN EPJ (Hg) Vom Schwarzwald zum Ries. Erdgeschichte mitteleuropäischer Regionen, Bd. 2, 165-176. München.
- POINTIER JP, SAMADI S, JARNE P & DELAY B (1998)
- Introduction and spread of Thiara granifera (Lamarck, 1822) in Martinique, French West Indies. Biod. Conserv. 7, 1277-1290.
- SAMADI S, DAVID P & JARNE P (2000)
- Variation of shell shape in the clonal snail Melanoides tuberculata and ist consequences for the interpretation of fossil series. Evolution 54, 492-502.
- WILLIAMSON PG (1981a)
- Palaeontological documentation of speciation in Cenozoic molluscs from Turcana Bassin. Nature 293, 437-443.
- WILLIAMSON PG (1981b)
- Morphological stasis and developmental constraint: real problem for neo-Darwinism. Nature 294, 214-215.
- WILLMANN R (1985)
- Die Art in Raum und Zeit. Berlin und Hamburg.
|
|  |
