 |
Zur Evolution des Bakterienrotationsmotors
Ist ein tragfähiges Modell für die Entstehung des bakteriellen Rotationsmotors bekannt?
von Siegfried Scherer
Studium Integrale Journal
17. Jahrgang / Heft 1 - Mai 2010
Seite 3 - 15
|
 |
Zusammenfassung: Der bakterielle Rotationsmotor wird häufig als Argument dafür genannt, dass die Entstehung nichtreduzierbar komplexer biologischer Strukturen durch Evolution nicht erklärt werden könne. Diese (postulierte) Nicht-Erklärbarkeit wird im Rahmen der Intelligent Design Bewegung als objektives Indiz für die Existenz eines Designers betrachtet.
Nicholas Matzke (2006) hat auf seiner privaten home page ein hypothetisches Evolutionsszenario vorgelegt, welches eine Neubewertung der kritischen Einwände zur Evolution des Bakterienmotors erfordert. Ausgehend von einer einfachen Pore in der Cytoplasmamembran unterteilt Matzke einen Evolutionsweg zum Bakterienmotor in 11 konkret benannte, aber hypothetische Schritte. Von jedem postulierten Evolutionsschritt wird angenommen, dass er gegenüber dem Vorgängerstadium einen Selektionsvorteil hat. Damit will Matzke zeigen, dass eine nichtreduzierbar komplexe biologische Struktur im Rahmen eines Evolutionsprozesses durch Variation und kumulative Selektion entstehen kann. Matzkes Modell ist wichtig, weil es bis heute die einzige Hypothese zur Evolution des Bakterienmotors ist, die wenigstens im Ansatz auf einer funktionalen molekularen Ebene formuliert wurde und deshalb zumindest theoretisch testbar ist. Im vorliegenden Artikel wird einer dieser 11 postulierten Evolutionsschritte auf dem Weg der Entstehung des Bakterienmotors, nämlich die Kooption* eines Adhäsionsproteins* genauer analysiert, weil dies einer der einfachsten Schritte in Matzkes Modell ist. Nur ein einziges Protein muss durch Kooption und Variation hinzugewonnen werden. Andere hypothetische Schritte in Matzkes Szenario sind weitaus komplexer.
Das Ergebnis dieser Analyse lautet, dass unbekannt ist, ob und wie durch Kooption und Mutation im Laufe der hypothetischen Entstehung des Bakterienmotors der Zugewinn eines einzigen Adhäsions-Proteins hätte ablaufen können. Obgleich Matzkes Modell einerseits zu einer Neubewertung der bisherigen evolutionskritischen Argumentation Anlass gibt1, ist es andererseits keine belastbare und überzeugende Hypothese zur Evolution des Bakterienmotors. Dafür spricht auch, dass es bis heute in der wissenschaftlichen evolutionsbiologischen Literatur nicht diskutiert wurde.
Hinsichtlich der Entstehung des Bakterienmotors besteht derzeit eine signifikante Erklärungslücke der Evolutionsforschung. Vielleicht wird sie durch künftige Daten oder plausible Theorien eines Tages geschlossen. Andererseits könnte es sich aber auch um ein fundamentales Problem handeln: Vielleicht kann der Ursprung des Bakterienmotors im Rahmen naturwissenschaftlicher Forschung grundsätzlich nicht erklärt werden. Eine empirisch begründete Entscheidung zwischen diesen Alternativen ist derzeit nicht möglich. Unabhängig davon, welcher der beiden Alternativen man zuneigen mag, motiviert diese Erklärungslücke jedoch zu weiteren evolutionsbiologischen Forschungen. Aus diesem Grund sind die Ausführungen in diesem Artikel keineswegs als finale Schlussfolgerungen, sondern als Beitrag zu einer konstruktiven Diskussion zu verstehen.
|  |
|
Einleitung
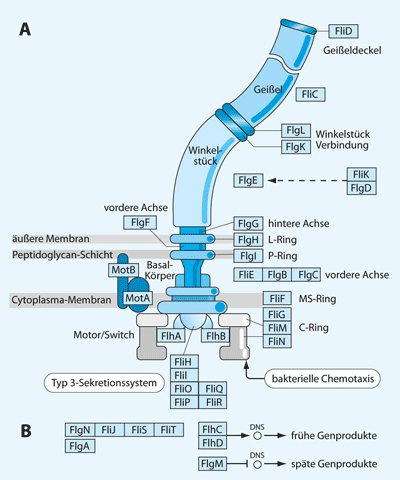 |
| Abb. 1: A Schematische Zeichnung des Bakterienmotors von Escherichia coli mit einigen der zugehörigen Strukturproteinen. B Regulatorische Genpodukte. (Aus Junker & Scherer 2006) |
|
Bakterien sind für ihr Wachstum darauf angewiesen, Nährstoffe aus ihrer Umgebung aufzunehmen. Dabei kann es sich als vorteilhaft erweisen, wenn sich die Zelle in einem Konzentrationsgefälle in Richtung einer Nährstoffquelle bewegen kann. Andererseits sind Bakterien auch negativen Umwelteinflüssen ausgesetzt, beispielsweise Giftstoffen. Auch hier ist eine aktive Bewegung, in diesem Fall weg von der Gefahrenquelle, von Vorteil. Zahlreiche Bakterien können sich auf unterschiedliche Weise aktiv bewegen (Jarrell & McBride 2008) und manche verfügen zu diesem Zweck über einen Rotationsmotor. Jeder Motor bedarf einer Steuerung. Dazu gehören Sensorproteine (diese können zum Beispiel Nährstoffmoleküle wie Zucker in der Zellumgebung erkennen, es handelt sich gewissermaßen um die „Nase“ der Bakterien), Signalübertragungsproteine (sie transportieren das eingegangene Umweltsignal zum Motor) und Schaltproteine (zur direkten Ansteuerung des Motors). In Bakterien wurden Motoren unterschiedlichster Konstruktionsart gefunden.
Der Motor des Darmbakteriums Escherichia coli ist auf genetischer und biochemischer Ebene am besten untersucht. Man weiß heute, dass er inklusive der zellulären Montageproteine (diese helfen beim Zusammenbau des Motors, vgl. Chevance & Hughes 2008) von etwa 40 Proteinen gebildet wird. Die darin enthaltene Steuerung durch Chemotaxis (d. i. mittels einem Stoffkonzentrationsgefälle; Übersicht z.B. in Wadhams & Armitage 2004) erfolgt durch weniger als 10 Proteine. Mit Hilfe molekularbiologischer und elektronenoptischer Verfahren konnte man die molekulare Grundstruktur des Motors aufklären (Abb. 1).
Ein Bakterienmotor besteht aus fünf Funktionsgrundelementen: Das Filament (Geißel) entspricht der „Schiffsschraube“. Durch Drehung des flexiblen Filaments wird der Vortrieb des Bakteriums erzeugt; es ist vor allem aus etwa 20.000 Kopien des Proteins Flagellin aufgebaut. Dieses Protein besteht wiederum aus mehreren hundert Aminosäuren. Das Filament ist über ein Winkelstück (Verbindungselement) an eine Rotationsachse gekoppelt, die von Lagern in der Cytoplasmamembran und der Zellwand der Bakterienzelle in Position gehalten wird. Die Gene, die für die Proteine der Achse und der Lager codieren, sind weitgehend bekannt. Die Achse und damit die Bakteriengeißel wird über Antriebsproteine in Rotation versetzt.
Der Motor wird von der Energie getrieben, die im Protonengradienten über der Cytoplasmamembran gespeichert ist. Dieser Protonengradient erzeugt außen eine gegenüber dem Cytoplasma positiv geladene Umgebung. Das Spannungsgefälle (= Membranpotential) beträgt rund 0,2 V. Bildlich gesprochen ist die Bakterienzelle eine „0,2V-Batterie“, die diesen „Nano-Elektromotor“ antreiben kann.
Hinsichtlich der evolutiven Entstehung eines Bakterienmotors muss eine ganze Reihe von Aspekten diskutiert werden (Scherer 2010). In diesem Artikel soll nur2 der Frage nachgegangen werden, ob Matzke eine belastbare, plausible Theorie für die evolutionäre Entstehung eines Bakterienrotationsmotors gibt. Die hier vorgebrachten Kernargumente wurden in Scherer (2009) erstmals entwickelt.
|
|
Das Design-Argument der nichtreduzierbaren Komplexität
In den letzten Jahren hat der Gebrauch von Begriffen aus den Ingenieurswissenschaften in der Molekularbiologie rasant zugenommen (Gene 2007). So ist der Begriff „molekulare Maschine“ inzwischen derart geläufig, um biologische Funktionseinheiten der Zelle zu beschreiben, dass er aus der einschlägigen Literatur nicht mehr wegzudenken ist. Das bakterielle Flagellum ist die molekulare Maschine mit dem größten Bekanntheitsgrad, da sie im Zusammenhang mit dem Design-Argument als Standardbeispiel für nichtreduzierbare Komplexität benutzt wird. Dieser Begriff und das darauf aufgebaute Argument wurden durch Michael Behes Buch „Darwin’s Black Box“ (Behe 1996a, deutsch 2007) weithin bekannt. Ein einzelnes System ist nichtreduzierbar komplex, wenn es notwendigerweise aus mehreren aufeinander abgestimmten, wechselwirkenden Teilen besteht, die an der Grundfunktion auf eine Weise beteiligt sind, dass die Entfernung eines beliebigen Teils diese Funktion restlos zerstört (nach Behe 1996a, 39). Auf dem Nachweis von nichtreduzierbarer Komplexität baut eine in der Intelligent Design Bewegung3 weit verbreitete, evolutionskritische Argumentation auf. Sie besagt, dass es unmöglich sei, ein nichtreduzierbar komplexes System durch ungerichtete evolutive Prozesse zu erzeugen, und dass dies ein objektives Argument für die Existenz eines Designers darstelle.
|
Affinität: Maß für die Stärke einer Bindung eines Moleküls (z.B. eines Proteins) an seinen Bindungspartner. Kooption: Übernahme eines bereits vorhandenen Proteins in einen neuen Funktionszusammenhang, i.d.R. im Zusammenhang mit Mutationen, welche das Ursprungsprotein verändern. Adhäsionsprotein: Protein mit einer Bindungseigenschaft an ein anderes Protein oder an niedermolekulare Moleküle (z.B. Zuckermoleküle auf Zelloberflächen). Domäne eines Proteins: Proteinabschnitt, der sich in der Regel relativ selbständig faltet und in der Raumstruktur eines Proteins von anderen Domänen deutlich abgesetzt ist. Oft tragen Domänen auch Funktionen (z.B. Bindungsfunktionen oder enzymatische Aktivitäten). Monomer: Einzelbaustein. Pseudogen: DNS-Abschnitt, der nicht in ein Protein übersetzt wird, aber große Ähnlichkeit zu einem Gen hat, welches in ein Protein übersetzt wird. phytopathogen: Krankheiten bei Pflanzen auslösend. sekretieren: ausscheiden, ausschleusen. Neutrale Evolution: Evolution, die im wesentlichen durch die Wirkung von Gendrift (zufällige Häufigkeitsveränderungen von Genfrequenzen) erfolgt. Durch Gendrift können z.B. durch Mutation neu entstandene Allele eines Gens in einer Population fixiert werden, auch wenn sie keinen Selektionsvorteil tragen.
|
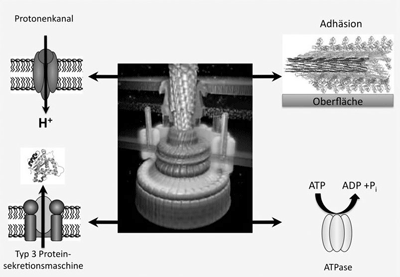 |
| Abb. 2: Ein Bakterienmotor ist eine komplexe molekulare Maschine, die aus mehreren, intensiv miteinander interagierenden kleineren molekularen Maschinen oder Funktionen besteht. In diesem Bild sind vier Funktionen gezeigt, es existieren noch weitere: Protonentransport, ATP-Spaltung, Sekretion und Adhäsion (Adhäsion ist eine einfache Funktion, keine Maschine). Abbildung des Motormodells mit Genehmigung (Protonic Nanomachine Project, Japan, HYPERLINK http://www.fbs.osaka-u.ac.jp/labs/namba/npn/top.html. |
|
Behe hat u.a. den bakteriellen Rotationsmotor als Beispiel für eine nichtreduzierbar komplexe Struktur angeführt. In der Natur existiert allerdings eine kaum überschaubare Vielfalt verschiedenster Bakterienmotoren (Jarrell & McBride 2008). Es hat sich aber herausgestellt, dass allen Motoren ein Kernset von etwa 20 Proteinen gemeinsam ist, die nach bisheriger Kenntnis für die Motorfunktion unentbehrlich sind (Pallen & Matzke 2006, Gene 2003, Liu & Ochman 2007b), was man z. B. durch knockout-Mutanten testen kann. Auch weitere Befunde sprechen dafür, dass die Komplexität eines heutigen Bakterienrotationsmotors nicht unter einen gewissen Schwellenwert fallen kann. Aufgrund heutiger experimenteller Daten besteht kein Zweifel mehr daran, dass es sich beim Bakterienrotationsmotor um eine nichtreduzierbar komplexe Struktur handelt. Das räumen inzwischen alle Kritiker ein.
An die Veröffentlichung von Behes Buch schloss sich allerdings eine intensive, leider oft polemisch geführte Diskussion über die Leistungsfähigkeit der bekannten Evolutionsfaktoren an. Dabei ging es zunächst um die Kernfrage, ob die Tatsache, dass eine Struktur nichtreduzierbar komplex ist, tatsächlich ein Argument dafür ist, dass sie nicht durch einen Evolutionsprozess entstehen kann. Die wichtigste Veröffentlichung, welche das Argument der nichtreduzierbaren Komplexität auf sachlicher Ebene am Beispiel des Bakterienrotationsmotors kritisiert, stammt von Matzke (2006). Obwohl das von Matzke erstmals im Jahr 2003 vorgeschlagene Modell bis heute nicht Bestandteil der wissenschaftlichen Literatur ist, sondern nur in Diskussionsforen und auf privaten Internetseiten publiziert wurde, und trotz dessen hochspekulativer Natur (s.u.), ist es aus zwei Gründen interessant: Erstens schlägt Matzke einen hypothetischen Weg vor, auf dem man sich die Entstehung des Bakterienmotors denken könnte, ohne dass alle wesentlichen Teile dieser nichtreduzierbar komplexen Maschine gleichzeitig vorhanden sein mussten. Zweitens ist es m.W. bis heute der einzige einigermaßen detaillierte, mechanistisch formulierte Vorschlag zur Entstehung eines Bakterienrotationsmotors.
Pallen & Matzke (2006) haben ebenfalls eine lesenswerte Kritik an Behes Argumentation vorgebracht, die sich im Wesentlichen jedoch auf Argumente aus der vergleichenden Biologie stützt und keine Mechanismenfragen diskutiert. Musgrave (2004), Miller (2004) sowie Pallen & Gophna (2007) kritisieren die Ansicht, dass das Flagellum nichtreduzierbar komplex sei, doch die genannten Argumente fokussieren auf die Multifunktionalität der Flagelle sowie ebenfalls auf Befunde aus der vergleichenden Biologie und werden im Kern von Matzke (2006) sowie Pallen & Matzke (2006) zusammengefasst. Aus diesem Grund werden in diesem Artikel hauptsächlich die beiden letztgenannten Arbeiten diskutiert.
|
|
Multifunktionalität von Bauteilen des Bakterienmotors
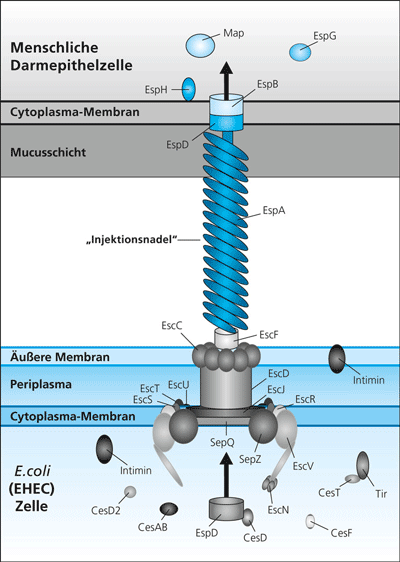 |
| Abb. 3: Schematische Darstellung des Typ 3-Sekretionssystems einer pathogenen Escherichia coli-Zelle (unten). Der Krankheitserreger lagert sich an eine Darmepithelzelle des Wirtes (oben) an. Das Sekretionssystem besteht aus einem Apparat, der die im E. coli-Cytoplasma synthetisierten Proteine zunächst über Cytoplasmamembran, Periplasma und äußere Membran transportiert. Durch eine molekulare „Injektionsnadel“ (v.a. aus dem Protein EspA aufgebaut), deren Spitze aus den Proteinen EspD und EspB in die Cytoplasmamembran der Wirtszelle inseriert, gelangen Effektorproteine (z.B. EspH, EspG) in deren Cytoplasma und „versklaven“ die menschliche Zelle. Die Erkrankung kann in ungünstigen Fällen zum Tod führen. Schema von Angelika Sell, verändert, aus verschiedenen Quellen zusammengestellt. |
|
Mit zunehmenden Sequenzdaten einerseits und wachsenden molekularbiologischen Einsichten andererseits wird immer deutlicher, dass biologische Strukturen gleichzeitig mehrere Funktionen haben können. Besonders eindrücklich ist der schon sehr lange bekannte überraschende Befund, dass Augenlinsenproteine (Crystalline) sowohl Strukturfunktion als auch enzymatische Funktionen haben können (Piatigorsky 1992, Piatigorsky 2003). Auch für das Flagellum wurden außer der Funktion als Motor weitere Funktionen beschrieben. Die Flagellen der vor allem durch Lebensmittel übertragenen Krankheitserreger Campylobacter jejuni und C. coli üben neben der Motorfunktion auch noch Funktionen bei der Sekretion von Virulenzfaktoren, der Autoagglutination, der Mikrokoloniebildung/Biofilmbildung sowie der Abwehr durch die angeborene Immunantwort aus (Guerry 2007).
In Abb. 2 sind vier Funktionen genannt, die mit dem Bakterienmotor verbunden sind. Das auf der Beobachtung der Multifunktionalität von Teilkomponenten beruhende Evolutionsmodell des Bakterienmotors beinhaltet als Kernstück die Vorstellung von „Evolution durch Mutation und Kooption“ (Gene 2003). Dieses Modell ist insbesondere durch die Entdeckung entstanden, dass die Proteine des Bakterienmotors durch einen ähnlichen Mechanismus über Cytoplasmamembran, Zellwand und äußere Membran transportiert werden, wie das bei den Typ 3-Sekretionssystemen (T3SS) von pathogenen Bakterien gefunden wurde (z.B. Galan 2008, Galan & Wolf-Watz 2006). Es handelt sich um eine „molekulare Spritze“, mit der ein Krankheitserreger Toxine direkt in eine Wirtszelle injizieren kann („Injektisom“, Abb. 3). T3SS können aber auch Proteine direkt in die Zellumgebung abgeben. Sie bestehen aus etwa 10 Proteinen. Man weiß, dass auch das zum Bakterienmotor gehörende und für dessen Aufbau unerlässliche T3SS Proteine sekretieren* kann, die nicht zum Bakterienmotor gehören. Von besonderem Interesse ist die neue Erkenntnis, dass der Proteintransport über T3SS nicht ATP-, sondern protonengetrieben ist und damit von der gleichen Energiequelle wie die Rotation der Flagelle gespeist wird (Galan 2008).
Ein Schema eines Typ 3-Sekretionssystems aus dem Krankheitserreger Eschichia coli O157 (EHEC) ist in Abb. 3 gezeigt. Die heutigen Typ 3-Sekretionssysteme sind hochkomplexe molekulare Maschinen. Evolutionstheoretisch muss man davon ausgehen, dass die Vorläufer dieser Maschinen deutlich einfacher gebaut waren. So kann begründet spekuliert werden, dass nicht ein komplexer Bakterienmotor am Anfang stand, sondern dass dieser auf die einfachere Struktur eines (allerdings als primitiv angenommenen) Typ 3-Sekretionssystems (ohne Motorfunktion) zurückgeht, welches in vielen Evolutionsschritten zusätzliche, bereits anderweitig in der Zelle vorhandene Proteine kooptierte und durch Mutation veränderte, bis schließlich die heutige, komplexe Motorfunktion entstand (Musgrave 2004, Matzke 2006).
Solche Doppelfunktionen widersprechen nicht dem Befund, das Flagellum sei nichtreduzierbar komplex, denn eine Zerstörung des Proteinsekretionsapparates des Flagellums führt zum Verlust der Motorfunktion, weil der Motor nicht mehr zusammengebaut werden kann. Es wäre denkbar, dass die Gesamtheit der Kernproteine jedes Bakterienmotors hinsichtlich der Motorfunktion eine nichtreduzierbar komplexe Struktur ist, und dass der darin enthaltene Sekretionsapparat hinsichtlich der Proteinsekretion ebenfalls eine – allerdings einfacher gebaute – nichtreduzierbar komplexe Struktur (mit anderer Funktion) ist.
Zwar ist die Existenz von Zweitfunktionen biologischer Strukturen für die Modellierung potentieller Evolutionswege außerordentlich bedeutsam (siehe unten). Ihre bloße Existenz bedeutet aber keineswegs (leider ist das Argument durchaus geläufig), dass damit die Evolution nichtreduzierbarer Strukturen schon geklärt sei. Dies wird im Folgenden diskutiert.
|
|
|
Evolutionäre Entstehung eines Bakterienmotors durch Mutation und Kooption
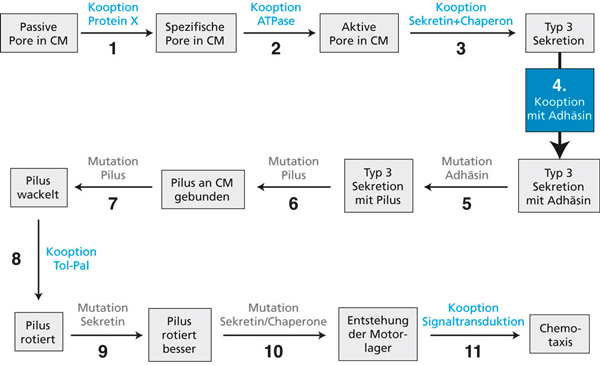 |
| Abb. 4: Evolution des Bakterienmotors durch Kooption und Mutation nach Matzke (2006). Kooptionen von vorhandenen Proteinen sind blau gezeichnet, wobei hier auch Mutationen notwendig sind. Die Kooption eines Adhäsins durch einen Typ 3-Sekretionsapparat ist mit einem dicken Pfeil hervorgehoben und wird hier als Beispiel benutzt, um die Voraussetzung für diesen Evolutionsschritt zu prüfen. |
|
Wenn der Bakterienmotor evolutiv entstanden ist, dann muss es Zwischenstufen gegeben haben, die entweder durch Selektion oder durch neutrale Evolution* in bakteriellen Populationen fixiert wurden. Diese Zwischenstufen müssen auf vorhandenen Strukturen aufgebaut sein, da sie nicht de novo (völlig neu) entstehen können. Ein Erkenntnisfortschritt ist nur zu erwarten, wenn derartige Zwischenstufen konkret vorgeschlagen und Übergänge zwischen ihnen genauer analysiert werden. Die Entdeckung, dass Teile des Bakterienmotors Zweitfunktionen ausüben, war ein wichtiger Schritt in diese Richtung. Von besonderer Bedeutung war in diesem Zusammenhang die schon erwähnte Fähigkeit des Bakterienmotors zur Sekretion von Proteinen.
Man weiß also, dass das T3SS zwar heute zum nichtreduzierbar komplexen Motor gehört, dass dieser Apparat jedoch auch eine andere Funktion hat, die unabhängig vom Rotationsmotor ist und deshalb auch unabhängig davon entstehen konnte. Man kann daher vermuten, dass ein ganz unabhängig vom Motor entstandenes, vorläufiges T3SS verwendet wurde, um darauf einen Motor aufzubauen. In anderen Worten: Die Entstehung eines „primitiven“ T3SS wäre damit eine funktionsfähige, durch Selektion stabilisierte Zwischenstufe auf dem Weg der Entstehung des Bakterienmotors und somit eine bedeutende Vereinfachung von dessen Evolution, wenn darauf aufbauend ein Flagellum evolvieren könnte. Solche Zwischenstufen habe ich als Basisfunktionszustände bezeichnet (Junker & Scherer 2006, Scherer 1983). Es ist das Verdienst von Matzke (2006), das m. W. bisher einzige spekulative Szenario zur Evolution des Bakterienmotors vorgeschlagen zu haben, welches detailliert genug ist, um zunächst einmal theoretisch geprüft zu werden. Ich habe Matzkes Evolutionsschritte zu diesem Zweck in Abb. 4 graphisch zusammengefasst.4
Das von Matzke entworfene Szenario ist eine phantasievolle Geschichte (das ist keineswegs abwertend gemeint, jede Naturwissenschaft lebt von kreativen Hypothesen). Sie beruht auf dem gedanklichen Postulat vieler selektionspositiver Zwischenstufen auf einem hypothetischen Evolutionsweg. Allerdings ist die Tatsache oder die Vermutung, dass eine neue oder veränderte Struktur die Fitness ihres Trägers erhöht, eine zwar notwendige, keineswegs aber eine hinreichende Bedingung dafür, dass sie durch Evolution entstehen kann. Zudem ist kritisch zu fragen, ob alle von Matzke postulierten Zwischenstufen tatsächlich einen Selektionsvorteil darstellen. Man muss solche Geschichten deshalb einem „reality check“ unterwerfen. Dieser kann nur so aussehen, dass die verschiedenen notwendigen Voraussetzungen für einen postulierten Evolutionsschritt so präzise wie möglich formuliert und die Wahrscheinlichkeiten der evolutionären Übergänge unter Berücksichtigung molekularbiologischer und populationsgenetischer Rahmenbedingungen abgeschätzt werden. Allerdings ist dies selbst in einfach scheinenden Fällen eine monumentale, nicht exakt zu lösende Aufgabe.
|
|
Detailanalyse: Kooption eines Adhäsin-Proteins nach Matzkeer Rahmen des ökologischen Erklärungsversuchs
Detailanalyse: Kooption eines Adhäsin-Proteins nach Matzke
Das Hauptverdienst von Matzke besteht darin, dass man die einzelnen von ihm postulierten Evolutionsschritte 1-11 (Abb. 4) grundsätzlich an bekannten experimentellen Daten prüfen kann. Als Beispiel dafür wähle ich Evolutionsschritt 4, und zwar deshalb, weil er sich sehr gut begründen lässt: Erstens weist der Bakterienmotor eine Sekretionsfunktion auf. Diese soll bereits auf unbekannte Weise entstanden sein und als Ausgangspunkt dienen. Zweitens weist die Geißel eine Adhäsionsfunktion auf, d.h. die Bakterienzelle kann mit der Geißel an Oberflächen binden. Das wurde für verschiedene Eubakterien gezeigt. Eine Adhäsionsfunktion ist unter bestimmten Bedingungen ein Selektionsvorteil und könnte sich daher durch Darwinsche Evolution etablieren, bevor eine Rotationsfunktion des Apparates auftritt. Drittens handelt es sich dabei nur um die Kooption (Übernahme in einen neuen Zusammenhang) und Mutation eines einzigen Proteins. Weniger als ein Protein kann nicht kooptiert werden, wir haben hier also einen minimalen Kooptionsschritt vor uns. Viertens könnte man sich vorstellen, dass eine noch nicht optimale Adhäsionsfunktion vielleicht durch eine überschaubare Zahl von Mutationen in einem präadaptierten Protein erzeugt werden kann. Fünftens könnte man dann vermuten, dass sich aus diesem anfänglichen Adhäsin durch nachfolgende Mutationen später die Flagelline (Bausteine der Geißel) entwickelten. Evolutionsschritt 4, der in Abb. 5 vereinfachend graphisch veranschaulicht ist, halte ich für einen der Übergänge auf dem in Abb. 4 beschriebenen Evolutionsweg, die auf den ersten Blick am leichtesten zu realisieren zu sein scheinen.
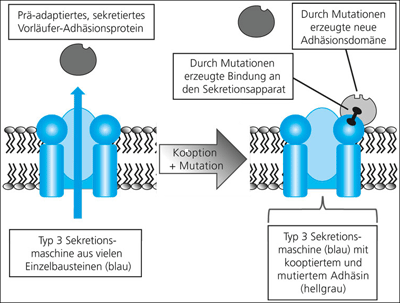 |
| Abb. 5: Kooption und Mutation eines präadaptierten Adhäsionsproteins an einen vorhandenen Typ 3-Sekretionsapparat. Der vorausgesetzte Sekretionsapparat ist sehr vereinfacht blau skizziert, das präadaptierte Protein, welches im Cytoplasma gebildet und dann über den Sekretionspparat sekretiert wird, ist kugelförmig grau gezeichnet. Es soll bereits eine Vorläufer-Adhäsionsdomäne besitzen. Nach Kooption und Mutation bindet das jetzt in ein Adhäsin verwandelte Protein an ein Protein auf der Außenseite des Sekretionsapparates (schwarze Hantel) und kann sich von dort aus an ein extrazelluläres Substrat anheften. |
|
Welche Vorgänge müssen postuliert werden, damit eine erfolgreiche Kooption ablaufen kann? Matzke hat sich nicht mit molekularbiologischen Details befasst. Gerade diese sind für eine aussagekräftige Beurteilung aber unerlässlich. Deshalb werde ich Matzke ergänzen und im Folgenden beispielhaft auf dieser Ebene argumentieren. In Abb. 6 sind die notwendigen Anforderungen für den in Abb. 4 skizzierten Evolutionsschritt zusammengestellt.
Präadaption des Vorläufergens
Zunächst sollte das Vorläuferprotein, welches kooptiert wird, von vorneherein gewissen Anforderungen entsprechen, damit der Evolutionsvorgang wahrscheinlicher wird. Ich setze deshalb voraus, dass dieses Protein präadaptiert (vorangepasst) war. Es soll also über einige strukturelle Merkmale verfügt haben, die dieses Protein gewissermaßen für das benötigte Adhäsionsprotein prädestinieren. Dazu gehört erstens, dass ein Sekretionssignal vorhanden war, welches von einem Sekretionsapparat erkannt werden kann; dieses Vorläuferprotein sollte also zu denjenigen gehören, die durch das schon auf unbekannte Weise evolvierte, „primitive“ Typ 3-Sekretionssystem sekretiert wurden. Zweitens soll vorausgesetzt werden, dass die Gesamtstruktur des Proteins eine Präadaption an eine Adhäsionsfunktion mitbrachte. Am einfachsten5 wäre es anzunehmen, dass das Ursprungsprotein bereits eine vorangepasste Domäne* aufwies, die nur noch in eine neue Adhäsionsspezifität umzuwandeln war. Das ist nicht abwegig, denn beispielsweise ist für jede enzymatische Funktion auch eine Bindung des zu spaltenden Substrates erforderlich. So muss durch Mutation keine völlig neue Adhäsionsdomäne erzeugt, sondern eine vorhandene Substratbindung muss nur noch in eine Adhäsionsfunktion transformiert werden.
Mutationen im Vorläufergen (1):
Genduplikation
Generell und aus gutem Grund wird vermutet, dass neue Gene vor allem durch Duplikation von vorhandenen Genen entstehen, wobei die ursprüngliche Funktion erhalten bleibt und die duplizierte Kopie frei ist, durch Mutationen eine abgewandelte oder neue Funktion anzunehmen, ohne dass die alte Funktion zerstört wird (Übersichten z.B. in Hughes 1994, Ohta 1989, Roth et al. 2007, Zhang 2003, Lynch 2002). Bergthorsson et al. (2007) haben einen Weg beschrieben, wie sich eine neue Funktion aus einer vorher schon vorhandenen Seitenfunktion (sozusagen einer „Präadaptation“) in einer Population etablieren könnte. In neueren Arbeiten wird die Entstehung einer neuen Funktion im Duplikat auch als Neofunktionalisierung bezeichnet (z.B. Beisswanger & Stephan 2008, Teshima & Innan 2008). Genduplikationen sind oft beobachtete Ereignisse, doch ist es relativ wahrscheinlich, dass als Resultat entweder ein funktionsloses Pseudogen* entsteht oder dass eine Subfunktionalisierung einsetzt. Darunter versteht man eine parallele Veränderung der Funktion des originalen und des duplizierten Gens, so dass beide zusammen die Funktion des ursprünglichen Gens ausführen (Hittinger & Carroll 2007, Hovav et al. 2008, Lynch & Force 2000, Lynch et al. 2001). Allerdings könnte Neofunktionalisierung möglicherweise auch über Subfunktionalisierung laufen (He & Zhang 2005, Rastogi & Liberles 2005). Ich postuliere hier, dass ein präadaptiertes Vorläufergen des Adhäsionsproteins zunächst dupliziert wurde und dann durch Mutationen in einer Kopie eine Adhäsionsfunktion dazu gewonnen hat (Neofunktionalisierung, Abb. 4 und 6).
Mutationen im Vorläufergen (2):
Bildung einer Adhäsions-Funktion
Wie kommt es im duplizierten, präadaptierten Vorläufergen zur Bildung einer Adhäsinfunktion? Man könnte daran denken, dass dieses sekretierte Vorläuferprotein Nahrungsquellen für das Bakterium erschließt (hochmolekulare Polysaccharide, Proteine, Nukleinsäuren) und zu diesem Zweck eine entsprechende enzymatische Funktion aufwies. Dadurch werden Polymere in Monomere* zerlegt, die aufgenommen werden können. Solche sekretierten, Polymer abbauenden Proteine könnten aber auch dazu dienen, andere Zellen zu zerstören. Eine ganze Reihe von solchen Enzymen wird beispielsweise in phytopathogenen* Mikroorganismen durch Typ 2-Sekretion ausgeschieden (z.B. Jha et al. 2005). Der Vorteil wäre, dass das Vorläuferprotein schon über eine Bindestelle verfügen würde. Diese müsste jetzt nur noch so umgebaut werden, dass eine zuverlässige Bindung ohne enzymatische Aktivität erfolgt. Der Selektionsvorteil der Bindung eines Bakteriums an ein abiotisches Substrat oder eine Pflanzenoberfläche liegt auf der Hand.
Kann man die Zahl der erforderlichen Mutationen am Ursprungsprotein abschätzen? Als einfaches Modell sehe ich ein polysaccharidabbauendes Enzym an (solche sekretierten Enzyme sind häufig). Es hat eine enzymatische Funktion, die Polysaccharide in Monomere oder Oligomere (Verbindung aus wenigen gleichen Bausteinen) zerlegt. Diese umfasst Substratbindung, diese Domäne könnte in eine Adhäsionsdomäne umgewandelt werden. Wenn sehr ähnliche Substrate vorliegen, kann die Bindungsspezifität oder auch die Affinität* an Polysaccharide durch einzelne Punktmutationen verändert werden (für Polysaccharidbindungsproteine siehe z.B. Simpson et al. 2000; für enzymatische Aktivitäten gibt es viele derartige Fälle, vgl. Junker & Scherer 2006, 143f.). Wenn aus einer Polysaccharidbindungsstelle eine Bindung für andere Kohlenhydrattypen neu erzeugt werden soll, dann liegt die erforderliche Zahl der Mutationen allerdings zwischen vier und 10 Aminosäureänderungen (Gunnarsson et al. 2004, dort Fig. 5). Voraussetzungen für einen Erfolg in dem hier betrachteten Beispiel sind, dass
(i) die enzymatische Funktion zerstört wird,
(ii) die Bindungsfunktion gleichzeitig erhalten bleibt und
(iii) so gestaltet wird, dass sie eine hinreichend hohe Affinität zum Substrat bekommt, um eine feste Bindung des Bakteriums zu gewährleisten.
 |
| Abb. 6: Zusammenstellung der Voraussetzungen und Veränderungen, die für die Kooption und Mutation eines präadaptierten Vorläuferproteins für ein Adhäsin im Text diskutiert werden. |
|
Alternativ kann man sich vorstellen, dass ein intrazelluläres „Adhäsin“, das möglicherweise bakterielle Polysaccharide binden konnte6, in ein Adhäsin umgewandelt wurde, das eine extrazelluläre Polysaccharidmatrix erkennt. Vielleicht kann die Umgestaltung der aktiven Seite des Proteins durch nur zwei Punktmutationen auf dem einen oder anderen Weg erreicht werden? Dazu sind m. W. zwar keine Experimente bekannt, solche könnte man aber durchführen, um diese Behauptung zu testen.7
Mutationen im Vorläufergen (3):
Kopplung des Adhäsionsproteins an die Sekretionsmaschine (Kooption)
Ein freies Adhäsionsprotein bringt keinen Selektionsvorteil für die Zelle, das Protein muss an die Zelloberfläche gekoppelt werden. Damit später eine weitergehende Evolution zum Bakterienmotor postuliert werden kann, muss die Kopplung an eines der auf der Zellaußenseite liegenden Proteine des schon vorhandenen Typ 3-Sekretionsapparates erfolgen.8 Es geht also um die Neuentstehung einer sehr stabilen, nicht-kovalenten Protein-Protein-Kopplung. Wieviele Mutationen sind dafür erforderlich? Die Erzeugung neuer Bindungsspezifitäten in Proteinen durch Laborevolution hat sich aufgrund biotechnologischer Interessen zu einem boomenden Forschungsgebiet entwickelt (Übersichten in Bershtein & Tawfik 2008, Kaur & Sharma 2006). Hier interessieren die Fälle, in denen aus einer Vorläuferstruktur, die bereits Bindungsfähigkeit besitzt (sog. scaffold9, Skerra 2007), eine neue Bindungsdomäne erzeugt wird, wobei im vorliegenden Zusammenhang nur reine Zufallsprozesse betrachtet werden, also die erstmalige Entstehung einer Bindungsfunktion. Optimierende Darwinsche Evolution, die auf bereits entstandenen Funktionen aufbaut und diese selektionsgetrieben verändert, wäre zwangsläufig im weiteren Verlauf der Evolution zu erwarten.
Aus biotechnologischen Gründen wurden vielfach neue Bindungsstellen erzeugt. Aus den Daten kann man ableiten, dass eine hinreichend starke neuartige Bindung an den Sekretionsapparat vielleicht nur fünf Aminosäureänderungen am Vorläuferprotein erfordert. Dabei muss zusätzlich beachtet werden, dass Aminosäureänderungen, die zur Kopplung an den Sekretionsapparat führen, die Adhäsionsstelle des Proteins an das externe Substrat nicht verändern. Möglicherweise ist die Zahl fünf eher tief gegriffen (Scherer 2010).
Mutationen im Sekretionsapparat
Das Adhäsionsprotein koppelt also an den Sekretionsapparat. Das hat eine Reihe von Konsequenzen, die in Abb. 7 zusammengefasst sind. Zunächst hemmt die Bindung eines Proteins an ein anderes Protein häufig die Funktion des ersten Proteins, was man in der Molekularbiologie seit Jahren zum Nachweis dafür benutzt, dass ein Protein eben eine bestimmte Funktion ausübt (z.B. Hemmung einer Reaktion durch Antikörperbindung). Das wäre jedoch in unserem Fall inakzeptabel, denn der Sekretionsapparat muss unbedingt funktionsfähig bleiben. Es wird deshalb vorgeschlagen, dass auch der Sekretionsapparat zunächst in dem betroffenen Kopplungsprotein durch Mutationen so verändert wird, dass die Funktion dieses Proteins nicht zu stark gehemmt wird. Außerdem darf durch diese Veränderungen die Funktion der anderen Proteine des Sekretionsapparates, die Bindungspartner des betroffenen Sekretionsproteins sind, nicht zu stark beeinträchtigt werden. Vielleicht sind hierfür weitere Mutationen erforderlich. Mutationen, die eine negative Folge einer vorigen Mutation aufheben, sind als kompensatorische Mutationen bekannt (Übersicht z.B. in Ferrer-Costa et al. 2007).
Eine zusätzliche Komplikation dürfte durch das Auftreten bisher nicht wirkender mechanischer Kräfte entstehen. Man muss bedenken, dass bei Bindung eines Bakteriums an ein festes Substrat selbst bei leichten Strömungen enorme Zug- und Scherkräfte auf den Sekretionsapparat wirken, denn dessen Größe im Verhältnis zur gesamten Zellmasse ist sehr klein. Das gilt auch dann, wenn eine Zelle mehrere Kopien des Sekretionsapparates ausbildet. Die vielfältigen Protein-Protein-Interaktionen innerhalb des Sekretionsapparates sind sicher nicht auf diese Zugkräfte ausgelegt, auch dieses Problem müsste vermutlich durch kompensatorische Mutationen ausgeglichen werden.
Wie viele derartige kompensatorische Mutationen sind nötig? Die Antwort auf diese Frage kennt niemand, die experimentelle Klärung dürfte schwierig sein und deshalb kann an dieser Stelle vorläufig nur ein Fragezeichen stehen.
Regulation der Expression des Adhäsins
Damit ein funktionsfähiges Gesamtkonstrukt entsteht, ist es notwendig, dass die Steuerung der Genexpression des duplizierten und mutierten Adhäsins einigermaßen passend ist. Das neue Adhäsin muss ungefähr zur richtigen Zeit und in etwa in der richtigen Menge produziert werden (Optimierungen durch nachfolgende Darwinsche Evolution sind kein grundsätzliches Problem). Die zugehörigen Regulationselemente müssen also durch Mutation auch gleichzeitig entstehen. Wie viele Veränderungen in der Promotorstruktur des duplizierten Gens dafür notwendig sind, kann derzeit datengestützt nicht abgeschätzt werden. Andererseits könnte man postulieren, dass das duplizierte Gen durch nicht-homologe, intrachromosomale Rekombination in ein Operon des Sekretionsapparates transferiert wird; damit hätte man zugleich die zeitliche Expressionssteuerung und vielleicht stimmt die produzierte Menge ja zufällig auch einigermaßen. Wie häufig ist eine solche lokal passende, doppelte intrachromosomale Rekombination?
Zuverlässige Messdaten zu solchen Frequenzen existieren m. W. kaum, aber ich schätze sie auf kleiner als 10-9 pro Zelle und Replikation (Hülter & Wackernagel 2008).
Fixierung der beiden neuen Loci in der Population
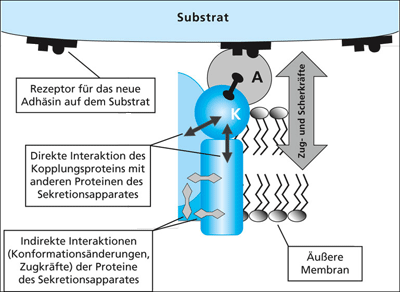 |
| Abb. 7: Interaktionen des Sekretionsapparates/Adhäsins mit dem Substrat für die Adhäsion und daraus folgende Wechselwirkungen sowie deren Bedeutung für die Interaktion verschiedener Proteine des Sekretionsapparates (schematische Darstellung), Einzelheiten im Text. |
|
Häufig bleibt bei evolutionären Hypothesen ein weiteres wichtiges Detail völlig unerwähnt. Vorausgesetzt, alle o. g. Änderungen seien irgendwie zustande gekommen: Nun muss sich die betroffene Bakterienzelle erst noch gegen ihre Konkurrenten durchsetzen. Das wird einerseits nur gelingen, wenn der positive Selektionskoeffizient hinreichend stark ist. Aber unabhängig davon besteht die signifikante Chance, dass trotz eines positiven Selektionskoeffizienten die neue Konstruktion durch Gendrift zufällig verschwindet, bevor sie die Chance hatte, sich durch Selektion durchzusetzen.
Die Fixierung von Mutationen in einer Population kann auch durch Neutrale Evolution und damit zunächst ohne Darwinsche Selektion erfolgen. Das Potential neutraler Evolution wird in Junker & Scherer (2006, 139f. und 162f.) diskutiert. Dort wird begründet, warum die Neutrale Evolutionstheorie – so bedeutend sie für das Verständnis evolutionärer Prozesse ist – m.E. derzeit keine überzeugende Lösung des Makroevolutionsproblems auf molekularer Basis bietet.
Kann die Wahrscheinlichkeit der Entstehung eines Bakterienmotors abgeschätzt werden?
Wie die vorstehende Diskussion gezeigt hat, kann die Evolutionsgeschichte von Matzke deutlich detaillierter erzählt werden. Das erst erlaubt einen allerdings noch groben reality check der Geschichte. Manches kann man dabei datengestützt abschätzen, anderes mangels Daten dagegen (noch?) nicht. Zur Zeit ist der Schluss m. E. gut begründet, dass die
Gesamtwahrscheinlichkeit für den betrachteten Evolutionsschritt sehr klein ist. Wie klein? Behe (1996b) meint:
„However, as the complexity of an interacting system increases, the likelihood of such an indirect route drops precipitously. And as the number of unexplained, irreducibly complex biological systems increases, our confidence that Darwin’s criterion of failure has been met skyrockets toward the maximum that science allows.“
Das ist eine steile Behauptung. Kann man zur „Wahrscheinlichkeit“ oder „Unwahrscheinlichkeit“ der Evolution eines Bakterienmotors eine Zahl nennen? Man könnte die Zahl der abgeschätzten Mutationen als unabhängig voneinander nehmen, ihre Einzelhäufigkeiten deshalb multiplizieren, und bekäme dann eine verschwindend winzige Zahl für das gleichzeitige Auftreten der Ereignisse in einer Zelle während einer Generation. Abgesehen von der Problematik der neutralen Evolution, welche eine solche Abschätzung ohnehin unmöglich macht (Junker & Scherer 2006, 162f.) würde jede konkrete Zahl eine unrealistische Exaktheit des Ergebnisses vortäuschen. Falls die resultierende Zahl sehr klein wäre, würde sie vielleicht zu der Folgerung Anlass geben, dass dadurch die Evolution des Bakterienmotors widerlegt sei. Das ist nicht das Ziel meiner Ausführungen (dazu s.u.). Tatsache ist, dass die wissenschaftliche Datenbasis für die Abschätzung einer Gesamtwahrscheinlichkeit derzeit nicht gegeben ist.
|
|
Matzkes Evolutionsszenario ist keine belastbare Hypothese zur Entstehung des Bakterienrotationsmotors
Unter anderem aus folgenden Gründen erweist sich Matzkes Kooptionshypothese zur Evolution des eubakteriellen Flagellums m.E. nicht als belastbare wissenschaftliche Hypothese.
Sind alle Zwischenstufen in Matzkes Modell selektionspositiv?
Bei manchen von Matzke postulierten Evolutionsschritten bleibt fraglich, ob die postulierten Evolutionsschritte tatsächlich einen Selektionsvorteil aufweisen. Ob beispielsweise die Schritte 5-8 in Abb. 4 selektionspositiv sind, erschließt sich jedenfalls nicht auf den ersten Blick, doch müsste diese Frage im Detail diskutiert werden.
Das Problem des grundlegenden Umbaus von Strukturen durch Mutationen
Wenn man abschätzen will, ob ein postulierter Evolutionsschritt so oder ähnlich tatsächlich hätte ablaufen können, dann muss man viel tiefer in molekulargenetische, mechanistische Details einsteigen, als dies in Matzke (2006) geschehen ist. Aus Matzkes Evolutionsgeschichte zur Entstehung des Bakterienmotors (Abb. 4) wurde einer der einfachsten und am besten begründbaren Schritte ausgewählt und hinsichtlich der vermutlich notwendigen Umbauten in den beteiligten Strukturen analysiert. Dabei ergibt sich eine ganze Reihe von schwerwiegenden ungelösten Problemen. Meine Schlussfolgerung aus dieser Diskussion lautet lediglich: Es ist unbekannt, wie durch Kooption und Variation im Laufe der hypothetischen Entstehung des Bakterienmotors der Zugewinn eines Adhäsins hätte ablaufen können. Selbstverständlich könnte es sein, dass wichtige Faktoren übersehen wurden und dass die Kooption eines Adhäsionsproteins an einen Sekretionsapparat irgendwie auf einem anderen Wege erfolgte. Vielleicht werden weitere Analysen oder andere Theorien das Problem lösen. Dann ergäbe sich die im Folgenden dargestellte Schwierigkeit.
Das Problem der evolutionären Kanalisierung
Sofern der Selektionskoeffizient groß genug ist, wird sich eine primitive anfängliche Adhäsionsfunktion in einer Population durchsetzen und wird darüber hinaus im weiteren Evolutionsverlauf durch den Darwinschen Selektionsmechanismus, welcher eine biologische Gesetzmäßigkeit darstellt, mit Notwendigkeit optimiert werden. Das wird graduell durch einzelne Mutationen in der Bindestelle und anderswo im Adhäsin sowie am Sekretionsapparat erfolgen. Je weiter dieser Optimierungsprozess fortschreitet, desto schwieriger wird es, an diese Funktion später eine neue Eigenschaft anzukoppeln, wie etwa Pilusbildung mit Kanal oder Rotation. Daraus ergibt sich, dass eine Adhäsionsfunktion (sollte sie denn entstehen) in eine evolutionäre Sackgasse führen muss, was die Entstehung einer rotierenden Flagelle anbelangt.
Das Problem der Begrenzung des
Variationsraumes bei Mehrfachfunktionen
Von Matzke wird postuliert, dass mehrere Adhäsine aneinander koppeln und auf diese Weise Adhäsinkomplexe entstehen, welche die Bindungsfunktion steigern (Matzke 2006, Stufe 3b). Damit das Sekretionssystem dabei nicht in seiner Funktion beeinträchtigt wird, muss man mit Matzke postulieren, dass die monomeren Adhäsine sich zu einem multimeren (mehrteiligen) Ring am Sekretionsapparat zusammenlagern und dabei eine Pore bilden, durch welche sekretierte Proteine ihren Weg nach außen finden können. Das wäre für eine Adhäsionsfunktion allerdings völlig unnötig und würde eine unbekannte Zahl zusätzlicher Änderungen an den Adhäsionsproteinen benötigen, damit diese aneinander und an den Sekretionsapparat binden und den Sekretionskanal bilden können. Eine Steigerung der Zahl der Adhäsionsproteine wäre viel einfacher durch Bindung von Adhäsinen an Zelloberflächenstrukturen zu erreichen, welche die Sekretionsfunktion gar nicht tangieren.
Das zugrunde liegende, allgemeine Problem ist die Begrenzung des Variationsraumes und daher der Evolutionsmöglichkeiten, wenn Strukturen eine Doppelfunktion ausführen müssen (oder später ausführen sollen) – hier ein einzelnes Protein, das (1) eine Adhäsionsfunktion bereits ausübt und (2) zusätzlich einen Sekretionskanal bilden und (3) später rotieren soll. Entweder wird auf Steigerung der Adhäsion hin optimiert, oder auf Bildung eines Sekretionskanals. Beides zugleich ist sehr unwahrscheinlich, weil durch die erforderliche Doppelfunktion nur wenige Mutationen zielführend sein werden. Dagegen wird es sehr viele Mutationen geben, die eine Adhäsionsfunktion verbessern. Der im Darwinschen Selektionsprozess eingebaute „Optimierungszwang“ wird nicht zur Bildung eines adhäsiven Sekretionskanals, sondern zu einer optimierten Adhäsion führen. Anders ausgedrückt: Matzke hat sich den Ring aus Adhäsionsproteinen ausschließlich deshalb zurechtgelegt, weil er diesen als Vorstufe für die Evolution der Flagelle in seinem Modell benötigt, womit eine versteckte teleologische Perspektive eingeführt wurde (s. Scherer 2010). Sollte aber wider Erwarten ein Sekretionskanal gebildet werden, wird der Variationsraum für eine spätere Rotation desselben desto mehr eingeschränkt (evolutionäre Kanalisierung).
Matzkes Modell wird in der Fachliteratur nicht diskutiert
Soweit mir bekannt, wurde Matzkes Modell in der referierten evolutionsbiologischen und mikrobiologischen Fachliteratur bis heute nicht diskutiert.10 Das ist erstaunlich, weil die Evolution des bakteriellen Flagellums das öffentliche Paradebeispiel in der Diskussion um Intelligent Design in den USA ist. Außerdem wurden alternative mechanistische (und somit theoretisch testbare) Evolutionsmodelle zum Bakterienmotor m.W. bis heute nicht vorgeschlagen. Darf man daraus schließen, dass die Fachwelt – sofern sie überhaupt Kenntnis davon genommen hat – Matzkes Modell für wenig überzeugend hält?
Zusammen mit Mark Pallen hat Matzke eine umfangreiche und lesenswerte Veröffentlichung in einem weltweit führenden mikrobiologischen Fachjournal über die Evolution des Bakterienmotors vorgelegt (Pallen & Matzke 2006). Matzkes einschlägiges, oben besprochenes Evolutionsmodell haben die beiden Autoren in ihrer eigenen Arbeit jedoch weder diskutiert noch als Argument benutzt.11 Trotzdem hat sich Johannes Sikorski kürzlich Matzkes Modell ohne inhaltliche Kritik oder Modifikation umfassend angeschlossen und es als „beeindruckendes und belastbares Modell zur Evolution des bakteriellen Flagellensystems“ gelobt (2009, 278). Diese Einschätzung entspricht den verfügbaren Daten nicht (s.o.) und wird von der Fachwelt jedenfalls bisher nicht unterstützt.
|
|
Zur Bedeutung von Erklärungslücken der Evolutionsforschung
Insgesamt liegt weder in der wissenschaftlichen Primärliteratur noch in der populären Literatur ein plausibles, mechanistisch begründetes Modell zur erstmaligen Entstehung des bakteriellen Rotationsmotors vor. Die Behauptung, die Evolution des Bakterienmotors sei grundsätzlich geklärt (Doolittle & Zhaxybayeva 2007, Liu & Ochman 2007b, Matzke 2006, Miller 2004, Musgrave 2004, Pallen & Matzke 2006, Wong et al. 2007), ist durch naturwissenschaftliche Daten daher nicht gedeckt. Es handelt sich um eine m.E. signifikante Erklärungslücke evolutionsbiologischer Forschung. Diese vorläufige Bilanz ist keineswegs als Ende der Diskussion gedacht, sondern als Aufforderung zur aktiven Weiterentwicklung aller für die Frage nach der Evolution des Bakterienmotors relevanten Argumente.
 |
Stoßen wir auf eine Erklärungslücke,
weil es einen bestimmten hypothetischen
Vorgang gar nicht gibt oder besteht
diese Lücke, weil wir nur noch
zu wenig wissen? |
 |
|
Als Naturwissenschaftler können wir vieles nicht erklären. Was aber kann man insbesondere aus den Erklärungslücken evolutionsbiologischer Forschung schlussfolgern? Stoßen wir auf eine Erklärungslücke, weil es einen bestimmten hypothetischen Vorgang gar nicht gibt oder besteht diese Lücke, weil wir nur noch zu wenig wissen? Grundsätzlich gilt, dass ungelöste Fragen zur Forschung motivieren, in diesem Fall zur Evolutionsforschung (Abb. 8, links). Das wird in jedem Fall weitere Daten erzeugen, welche die Erklärungslücke schließen könnten. Die Evolutionsbiologie hätte dann für dieses Problem eine befriedigende Lösung. Ergebnisoffene Evolutionsforschung ist deshalb zwingend notwendig, und das sollte unter Biologen, gleich welcher Weltanschauung, unstrittig sein. Wenn neue Daten keine Lösung bringen – nun, dann muss eben weiter geforscht werden. Diesen Zyklus wird man erfahrungsgemäß oft durchlaufen und viele Probleme werden am Ende einer naturwissenschaftlichen Lösung zugeführt werden. Manche vielleicht aber auch nicht.
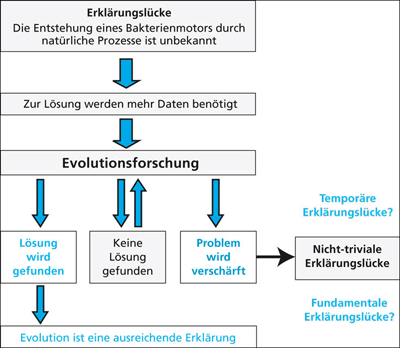 |
| Abb. 8: Konsequenzen aus evolutionsbiologischen Erklärungslücken. (Nach Scherer 2009, verändert) |
|
Möglicherweise kommt es im Rahmen weiterer experimenteller und theoretischer Forschung nicht zu einer Lösung, sondern zu einer Verschärfung des Problems. Es könnte sein, dass man durch das Problem auf eine Erklärungslücke gestoßen ist, die sich durch Anwendung heute bekannter Techniken und Theorien nicht schließen lässt. Ich nenne eine solche Erklärungslücke „nicht-trivial“. In einer solchen Situation werden m.W. drei Haltungen eingenommen, die ich im Folgenden kurz nenne.12
Fall 1 ist die naturalistische Haltung: Man glaubt, dass es ganz sicher einen Weg gibt, und früher oder später werde man ihn finden. Dann wäre die Erklärungslücke temporär. Man wird in diesem Fall davon ausgehen, dass die künftige Forschung das Problem löst. Das kann man schwerlich ausschließen. Die Möglichkeit, dass tatsächlich „Nicht-Erklärbarkeit“ vorliegt, lässt sich allerdings auch nicht im Vorhinein ausschließen. Wer bei Vorliegen von „Nicht-Erklärtheit“ die Möglichkeit der „Nicht-Erklärbarkeit“ einer biologischen Struktur grundsätzlich ablehnt, formuliert einen Glaubenssatz. Wenn es tatsächlich keinen natürlichen Mechanismus zur Entstehung des Bakterienmotors gäbe, würde die naturalistische Haltung in einen unendlichen, ergebnislosen Zirkel führen. Sie käme in einem gewissen Sinne einem Verzicht auf Erklärung13 gleich, wenn es sich beim Bakterienmotor in Wahrheit um eine geschaffene Konstruktion handeln würde.
Fall 2 ist die Haltung des Intelligent Design, die Nicht-Erklärtheit im Zusammenhang mit Designer-typischen Kennzeichen als Verdacht auf Nicht-Erklärbarkeit wertet: Es gibt keinen natürlichen Weg zur Entstehung einer molekularen Maschine wie dem Bakterienmotor. Dieser könnte14 aber auf unbekannte Weise von einem Designer konstruiert worden sein. Die Erklärungslücke wäre fundamental. Wer aus dem Befund von „Nicht-Erklärtheit“ auf „Nicht-Erklärbarkeit“ einer biologischen Struktur schließt, formuliert allerdings einen Glaubenssatz. Die Position des ID könnte dazu führen, dass die Erforschung des Problems deshalb aufgegeben wird, weil man es für unlösbar hält. Aber wenn es nun doch lösbar wäre? Vielleicht haben wir in einigen Jahren eine plausible Erklärung für die natürliche Entstehung des Bakterienmotors? Weil das der Fall sein könnte, führt ein richtig verstandener Design-Ansatz zu evolutionsbiologischer Forschung: Wissenszuwachs ist notwendig, um herausfinden zu können, ob Erklärungslücken möglicherweise fundamental sind oder ob der Design-Ansatz dadurch scheitert, dass eine natürliche Erklärung gefunden wird.
Fall 3 ist schließlich die abwartende Haltung: Man kann den Fall nicht entscheiden, es existiert eine Erklärungslücke, die zunächst einfach stehen bleiben muss. Ich kenne eine ganze Reihe von Biologen, die diese Meinung vertreten. Als Naturwissenschaftler teile ich diese Haltung, doch darf sie nicht in einem resignativen, agnostischen Sinn verstanden werden. Sonst würde die Gefahr bestehen, dass auf Forschung verzichtet wird, weil man glaubt, sowieso nichts Sicheres wissen zu können.
Zwischen Fall 1 und Fall 2 besteht m.E. jedoch ein grundsätzlicher Unterschied. Es könnte sein (und das war in der Vergangenheit nicht selten der Fall), dass die Entscheidung, ob Erklärungslücken temporär sind, definitiv getroffen werden kann. Beim Bakterienmotor wäre dies dann gegeben, falls künftig eine plausible evolutionäre Entstehungshypothese formuliert werden würde. Ob eine Wissenslücke fundamental ist, kann dagegen schwerlich mit Bestimmtheit behauptet werden, denn man weiß nie sicher, ob in Zukunft nicht vielleicht doch eine naturwissenschaftliche Erklärung für eine gegebene evolutionsbiologische Wissenslücke erforscht wird. Soweit ich sehe steht jede ID-Deutung unter einem prinzipiellen Vorbehalt.
Welche Haltung man aus welchen Gründen auch immer einnimmt – an weiterer Evolutionsforschung sowie an deren naturwissenschaftlicher Kritik führt kein Weg vorbei. Sowohl der Verzicht auf weitere Evolutionsforschung als auch der Verzicht auf die kritische Hinterfragung ihrer Ergebnisse wäre wissenschaftsfeindlich. Das erste kommt im ideologischen Kreationismus15 vor, das zweite ist ein Kennzeichen des fundamentalistischen Evolutionismus.16
Evolutionsforschung wird immer wichtige Aussagen über Reichweite und Grenzen naturwissenschaftlich erforschbarer Evolutionsprozesse liefern. Ich kann und will als Biowissenschaftler nicht ausschließen, dass die künftige Evolutionsforschung befriedigende natürliche Erklärungen für die Entstehung des Lebens, des Bakterienmotors und der überwältigenden Komplexität des Lebens finden wird. Wenn es solche Erklärungen gibt, werde ich nach meinen Möglichkeiten zu ihrer Erforschung beitragen. Ebenso wenig kann man derzeit ausschließen, dass die in diesem Artikel dargestellte Erklärungslücke evolutionsbiologischer Forschung nicht nur temporärer, sondern fundamentaler Natur ist. Wäre das ein Indiz für Schöpfung? Als Naturwissenschaftler kann ich diese Frage nicht beantworten.
|
Anmerkungen
1 Das betrifft auch den entsprechenden Abschnitt in Junker & Scherer (2006), siehe dazu Scherer (2010)
2 Eine ganze Reihe weiterer Aspekte wird in Scherer (2010) diskutiert.
3 Die Intelligent Design Bewegung kann an dieser Stelle aus Platzgründen nicht einmal ansatzweise behandelt werden, daher verweise ich auf Junker (2009) und Rammerstorfer (2010).
4 Eine entsprechende, für den Laien umwerfend überzeugend klingende und keinerlei Probleme offen lassende Evolutionsgeschichte ist unter http://www.youtube.com/ watch?v=SdwTwNPyR9w abrufbar. Im Grunde grenzt dieses Video leider an eine Verdummung des unkundigen Zuschauers.
5 Noch einfacher wäre es, wenn bereits ein funktionales Adhäsionsprotein kooptiert würde. Allerdings müsste dieses dann schon anderweitig in der äußeren Membran verankert gewesen sein, was man von verschiedenen Adhäsinen kennt. In diesem Fall würde der Wechsel an den Sekretionsapparat jedoch keine neue Funktion erzeugen und damit auch nicht zu einer höheren Fitness führen.
6 Vielleicht in der Mureinzellwand? Man kennt eine ganze Reihe von Polysaccharid-Bindungsdomänen von bakteriellen Enzymen.
7 Dies ist ein Beispiel dafür, wie evolutionskritische Analysen die Evolutionsforschung voranbringen können.
8 Wenn man das fordert hat man als Erzähler der Geschichte selbstverständlich die zu diesem Zeitpunkt noch gar nicht aktuelle Notwendigkeit vor Augen, dass der Evolutionsweg in Richtung Flagellum führen muss.
9 Unter „scaffold“ (Baugerüst) versteht man ein Protein, welches als Gesamtkonstruktion schon wesentliche Merkmale besitzt, die für die neu zu konstruierende Funktion wichtig sind. Ein scaffold ist gewissermaßen ein präadaptiertes Protein, obgleich dies im biotechnologischen Sprachgebrauch nicht so genannt wird.
10 Das gilt auch für den mir bisher einzigen bekannten Fall, in dem Matzkes Internet-Text in einer referierten Zeitschrift zitiert wurde (Pallen et al. 2006). Sollte es andere Arbeiten geben, bin ich für einen Hinweis dankbar.
11 Matzkes Modell wird nicht einmal als Referenz zitiert, im Text findet sich kein Bezug, lediglich der Titel und die Internetadresse von Matzkes Arbeit wird im Anhang unter „Further Information“ genannt.
12 Eine manchmal gewählte vierte Lösung besteht in der Negation: Man behauptet einfach, es gäbe gar kein Problem, denn die Evolutionstheorie habe alle grundsätzlichen Probleme (nicht die zahlreichen Detailfragen) bereits gelöst. Deshalb gäbe es keine valide grundsätzliche Kritik. Diese Haltung gibt es sowohl in atheistischen als auch in christlichen Kreisen und man könnte sie objektiv und wissenschaftlich diskutieren. Das aber ist nur möglich, wenn die Bereitschaft zum sachlichen, ergebnisoffenen wissenschaftlichen Disput vorhanden ist. Obgleich dies unter Wissenschaftlern eigentlich selbstverständlich sein sollte, zeigt die Erfahrung, dass man eine solche Bereitschaft nicht ohne weiteres voraussetzen kann, wenn Positionen nicht nur naturwissenschaftlich, sondern auch weltanschaulich bedingt sind.
13 Der Begriff „Erklärung“ ist hier nicht im naturwissenschaftlichen Sinne (also einer Ableitung aus Gesetzmäßigkeiten und Randbedingungen) zu verstehen.
14 Es gibt politisch motivierte ID-Varianten in den USA, welche versuchen, einen Designer aus naturwissenschaftlichen Daten abzuleiten. Das halte ich für eine unangemessene Grenzüberschreitung.
15 Nicht alle Vertreter des Kreationismus sind ideologisch eingestellt.
16 Nicht alle Vertreter des Evolutionismus sind fundamentalistisch eingestellt.
|
|
|
Literatur
- Behe M (1996a)
- Darwin’s Black Box. New York.
- Behe M (1996b)
- Evidence for Intelligent Design from Biochemistry. http://www.arn.org/docs/behe/mb_idfrombiochemistry.htm.
- Beisswanger S & Stephan W (2008)
- Evidence that strong positive selection drives neofunctionalization in the tandemly duplicated polyhomeotic genes in Drosophila. Proc. Natl. Acad. Sci. USA 105, 5447-5452.
- Bergthorsson U, Andersson DI & Roth JR (2007)
- Ohno’s dilemma: evolution of new genes under continuous selection. Proc. Natl. Acad. Sci. USA 104, 17004-17009.
- Bershtein S & Tawfik DS (2008)
- Advances in laboratory evolution of enzymes. Curr. Opin. Chem. Biol. 12, 151-158.
- Chevance FF & Hughes KT (2008)
- Coordinating assembly of a bacterial macromolecular machine. Nat. Rev. Microbiol. 6, 455-465.
- Doolittle WF & Zhaxybayeva O (2007)
- Evolution: reducible complexity – the case for bacterial flagella. Curr. Biol. 17, R510-512.
- Ferrer-Costa C, Orozco M & de la Cruz X (2007)
- Characterization of compensated mutations in terms of structural and physico-chemical properties. J. Mol. Biol. 365, 249-256.
- Galan JE (2008)
- Energizing type III secretion machines: what is the fuel? Nat. Struct. Mol. Biol. 15, 127-128.
- Galan JE & Wolf-Watz H (2006)
- Protein delivery into eukaryotic cells by type III secretion machines. Nature 444, 567-573.
- Gene M (2003)
- Evolving the bacterial flagellum through mutation and cooption. In: http://www.idthink.net/biot/index.html, files flag1-flag7. pp.
- Gene M (2007)
- The Design Matrix. A consilience of clues. Arbo Vitae Press, USA.
- Guerry P (2007)
- Campylobacter flagella: not just for motility. Trends Microbiol. 15, 456-461.
- Gunnarsson CL, Karlsson EN, Albrekt AS, Andersson M, Holst O & Ohlin M (2004)
- A carbohydrate binding module as a diversity-carrying scaffold. Prot. Eng. Design Sel. 17, 213-221.
- He X & Zhang J (2005)
- Rapid subfunctionalization accompanied by prolonged and substantial neofunctionalization in duplicate gene evolution. Genetics 169, 1157-1164.
- Hittinger CT & Carroll SB (2007)
- Gene duplication and the adaptive evolution of a classic genetic switch. Nature 449, 677-681.
- Hovav R, Udall JA, Chaudhary B, Rapp R, Flagel L & Wendel JF (2008)
- Partitioned expression of duplicated genes during development and evolution of a single cell in a polyploid plant. Proc. Natl. Acad. Sci. USA 105, 6191-6195.
- Hughes AL (1994)
- The evolution of functionally novel proteins after gene duplication. Proc. Biol. Sci. 256, 119-124.
- Hülter N & Wackernagel W (2008)
- Double illegitimate recombination events integrate DNA segments through two different mechanisms during natural transformation of Acinetobacter baylyi. Mol. Microbiol. 67, 984-995.
- Jarrell KF & McBride MJ (2008)
- The surprisingly diverse ways that prokaryotes move. Nat. Rev. Microbiol. 6, 466-476.
- Jha G, Rajeshwari R & Sonti RV (2005)
- Bacterial type two secretion system secreted proteins: double-edged swords for plant pathogens. Mol. Plant-Microbe Interact. 18, 891-898.
- Junker R (2009)
- Spuren Gottes in der Schöpfung? Eine kritische Analyse von Design-Argumenten in der Biologie. Studium Integrale. Holzgerlingen.
- Junker R & Scherer S (2006)
- Evolution, ein kritisches Lehrbuch. Weyel Verlag, Gießen
- Kaur J & Sharma R (2006)
- Directed evolution: an approach to engineer enzymes. Crit. Rev. Biotechnol. 26, 165-199.
- Liu R & Ochman H (2007b)
- Stepwise formation of the bacterial flagellarsystem. Proc. Natl. Acad. Sci. USA 104, 7116-7121.
- Lynch M (2002)
- Genomics. Gene duplication and evolution. Science 297, 945-947.
- Lynch M & Force A (2000)
- The probability of duplicate gene preservation by subfunctionalization. Genetics 154, 459-473.
- Lynch M, O’Hely M, Walsh B & Force A (2001)
- The probability of preservation of a newly arisen gene duplicate. Genetics 159, 1789-1804.
- Matzke NJ (2006)
- Evolution in (Brownian) space: a model for the origin of the bacterial flagellum. In: http://www.talkdesign.org/faqs/flagellum.html. Aktualisierte Fassung einer im Jahr 2003 erstmals publizierten Version.
- Miller KR (2004)
- The Flagellum Unspun. In: Debating Design: from Darwin to DNA. W. Dembski & M. Ruse (eds). New York.: Cambridge University Press, pp. 81-97.
- Musgrave I (2004)
- Evolution of the bacterial flagellum. In: Young M & Edis T (eds) Why intelligent design fails. New Brundswick: Rudgers University Press, pp. 72-84.
- Ohta T (1989)
- Role of gene duplication in evolution. Genome 31, 304-310.
- Pallen MJ & Matzke NJ (2006)
- From The Origin of Species to the origin of bacterial flagella. Nat. Rev. Microbiol. 4, 784-790.
- Piatigorsky J (1992)
- Lens crystallins. Innovation associated with changes in gene regulation. J. Biol. Chem. 267, 4277-4280.
- Piatigorsky J (2003)
- Gene Sharing, Lens Crystallins and Speculations on an Eye/Ear Evolutionary Relationship. Integr. Comp. Biol. 43; 492-499.
- Rammerstorfer M (2010)
- Lebewesen und Design. Eine Einführung. Norderstedt.
- Rastogi S & Liberles DA (2005)
- Subfunctionalization of duplicated genes as a transition state to neofunctionalization. BMC Evol. Biol. 5, 28.
- Roth C, Rastogi S, Arvestad L, Dittmar K, Light S, Ekman D & Liberles DA (2007)
- Evolution after gene duplication: models, mechanisms, sequences, systems, and organisms. J. Exp. Zoolog. B. Mol. Dev. Evol. 308, 58-73.
- Scherer S (1983)
- Basic functional states in the evolution of cyclic photosynthetic electron transport. J. Theor. Biol. 104, 289-299.
- Scherer S (2009)
- Makroevolution molekularer Maschinen. Konsequenzen aus den Wissenslücken evolutionsbiologischer Naturforschung. In: Hahn HJ, McClary R & Thim-Mabrey C (eds) Atheistischer und jüdisch-christlicher Glaube: Wie wird Naturwissenschaft geprägt? Norderstedt: Books on Demand, pp. 95-149.
- Scherer S (2010)
- Die Entstehung des bakteriellen Rotationsmotors ist unbekannt. www.evolutionslehrbuch.info/teil-4/kapitel-09-04-r01.pdf
- Sikorski J (2009)
- Die bakterielle Flagelle – Stand der Forschung zu molekularem Aufbau, Diversität und Funktion. In: Neukamm M (ed) Evolution im Fadenkreuz des Kreationismus. Göttingen: Vandenhoeck & Ruprecht, pp. 262-301.
- Simpson PJ, Xie H, Bolam DN, Gilbert HJ & Williamson M P (2000)
- The structural basis for the ligand specificity of family 2 carbohydrate-binding modules. J. Biol. Chem. 275, 41137-41142.
- Skerra A (2007)
- Alternative non-antibody scaffolds for molecular recognition. Curr. Opin. Biotechnol. 18, 295-304.
- Teshima KM & Innan H (2008)
- Neofunctionalization of duplicated genes under the pressure of gene conversion. Genetics 178, 1385-1398.
- Wadhams GH & Armitage JP (2004)
- Making sense of it all: bacterial chemotaxis. Nat. Rev. Mol. Cell. Biol. 5, 1024-1037.
- Wong T, Amidi A, Dodds A, Siddiqi S, Wang J, Yep T, Tamang DG & Saier MH (2007)
- Evolution of the bacterial flagellum. Microbe 2, 335-340.
- Zhang J (2003)
- Evolution by gene duplication: an update. Trends Ecol. Evol. 18, 292-298.
-
-
|
|  |
