 |
Die fehlenden Spiegelbilder
Erklärungsversuche für das Phänomen der natürlichen Homochiralität von Peter Imming
Studium Integrale Journal
13. Jahrgang / Heft 1 - Mai 2006
Seite 14 - 21
|
 |
Zusammenfassung: Sehr viele für Leben essentielle Moleküle kommen in der Natur nur in einer von zwei spiegelbildlichen Formen vor bzw. nur die eine Form ist in einem bestimmten Organismus oder für eine bestimmte Funktion brauchbar. Diese molekulare Asymmetrie der Natur nennt man Homochiralität. Es ist prinzipiell unklar, wie es in einer hypothetischen präbiotischen Welt ohne äußeren Eingriff zu einer Selektion der einen spiegelbildlichen Form gekommen sein kann. Die verschiedenen Erklärungshypothesen werden im Detail diskutiert. Das Phänomen der Homochiralität wird sofort verständlich, wenn wir nicht auf der Basis unseres Nicht-Wissens, sondern unseres Wissens um die Herstellung reiner Enantiomere an die Fragestellung herangehen.
|  |
|
Das Phänomen der Homochiralität in der Schöpfung
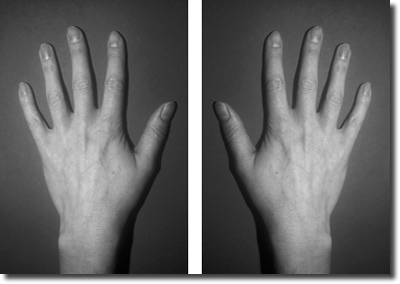 |
| Abb.1: Hände sind ein Beispiel für chirale Objekte. Das Wort chiral stammt von griech. „cheir“ (Hand). |
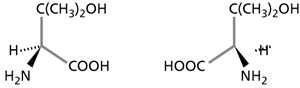 |
| Abb.2: Die Enantiomere von Penicillamin. |
|
Für die Existenz von Leben, wie wir es beobachten, sind außerordentlich viele Voraussetzungen nötig. Eine davon betrifft die genaue räumliche Gestalt lebensnotwendiger Moleküle. Aminosäuren, Zucker und sehr viele andere essentielle Lebens-Bausteine kommen in der Natur nur in einer von zwei spiegelbildlichen Formen vor bzw. nur die eine Form ist in einem bestimmten Organismus oder für eine bestimmte Funktion brauchbar. Diese molekulare Asymmetrie der Natur nennt man Homochiralität. Chiralität ist die Erscheinung, daß Moleküle oder sonstige Gegenstände in zwei zueinander spiegelbildlichen, nicht kongruenten (nicht übereinstimmenden, deckungsgleichen) Formen existieren können. Chiralität heißt übersetzt „Händigkeit“; denn die Hände sind ein Beispiel für chirale Objekte (vgl. Abb. 1). Den Begriff „Chiralität“ prägte Lord Kelvin in einer Fußnote seiner „Baltimore Lectures“ (Kelvin 1904). Zwei zueinander spiegelbildliche Moleküle heißen Enantiomere, ein 1:1-Gemisch zweier Enantiomere Racemat.
So ähnlich sich Enantiomere sind – sie können sich gegenseitig nicht ersetzen. Eine Diät, die statt L- nur D-Aminosäuren enthielte, würde rasch zum Tode durch Mangelernährung führen. „L“ und „D“ ist eine von zwei gängigen chemischen Nomenklaturen, um sprachlich Enantiomere zu unterscheiden. Bei Arzneistoffen spielt Chiralität ebenfalls eine große Rolle. Abb. 2 zeigt die Enantiomere von Penicillamin – das eine wird als Rheumamittel eingesetzt, das andere ist giftig. Ein Hersteller des Rheumamittels wird es nicht dem Zufall überlassen wollen, ob sein Produkt frei vom giftigen Enantiomer ist ... D-Penicillamin wird entweder aus einem Ausgangsmaterial hergestellt (Penicillin), das naturbedingt nur D-Penicillamin liefert, oder es wird im Laufe der Totalsynthese eine Trennung der Enantiomere durchgeführt, die ihrerseits ein enantiomerenreines Reagenz benötigt (Kleemann et al. 2001).
|
|
Rätsel Homochiraliät
Homochiralität bedeutet, daß von den beiden Enantiomeren nur das eine vorgefunden wird. Genau das ist eines der großen Naturrätsel. Vor der Entstehung von Lebewesen muß irgendwann die Entscheidung zugunsten der einen Sorte von Enantiomeren gefallen sein. Auf der Ebene lebender Organismen führt die Konkurrenz von Individuen und Arten zu Selektionsprozessen. Bei Enantiomeren mit chemisch gleichem Energiegehalt existiert ein auf Konkurrenz basierender Selektionsprozeß nicht. Daher ist prinzipiell unklar, wie es in einer hypothetischen präbiotischen Welt ohne äußeren Eingriff zu einer Selektion kommen kann. Läßt man die Möglichkeit eines geplanten, steuernden Eingriffs nicht zu, so sind beide Alternativen – L und D – für ein chirales Molekül exakt gleich wahrscheinlich. Abb. 3 und 5 sollen das Phänomen veranschaulichen.
Aufgrund seiner Erfahrungen mit Synthesen ist ein Chemiker mit der Entstehung der Homochiralität vertraut und kann sie verstehen. Wenn man dagegen die Moleküle sich selbst überläßt, scheint die Entstehung und Aufrechterhaltung dieses Naturphänomens im Rahmen der bekannten Gesetze der Chemie und Physik in einer unbelebten (präbiotischen) Welt grundsätzlich nicht vorstellbar. Naturalistische Erklärungen werden trotzdem gesucht (Cline 1996, Feringa & van Delden 1999, Bonner 2000). Diese Hypothesen lassen sich in eine von vier Gruppen (1)-(4) einordnen:
 |
| Abb.3: Das linke Photo zeigt den Autor dieses Beitrags vor einem Spiegel sitzend und eine Zeitschrift in der Hand haltend. Auf dem rechten Photo ist das Spiegelbild des Autors verschwunden. Jedem Betrachter ist klar: hier ist bewußt manipuliert worden. Die beiden Photos sind als Veranschaulichung der Überraschung – und der naheliegenden Erklärung – gedacht, die das Fehlen der Spiegelbilder in der Natur beim Chemiker auslöst. |
|
(1) Paritätsverletzung auf atomarer Ebene
Enantiomere haben aufgrund der Paritätsverletzung auf atomarer Ebene bei der schwachen Wechselwirkung einen winzig kleinen Energieunterschied (siehe Lehrbücher der Physik). Bei Aminosäuren beträgt er ca. 2 x 10-17 kJ/mol. Resultiert daraus ein Energieunterschied von Enantiomeren, der zur Bevorzugung des einen führte und führt? Nein: „Es gibt zwar schwache asymmetrische Kräfte in der unbelebten Natur, aber jedes geringfügige Vorherrschen von D- oder L-Formen bei präbiotischen Prozessen würde in einer geologischen Umgebung durch Razemisierungsreaktionen wieder aufgehoben werden“ (Dose 1987). Auch Bonner (2000) kommt in seinem ausführlichen Übersichtsartikel zu dem Schluß, daß die Paritätsverletzungen auf der atomaren und auf der molekularen Ebene (Homochiralität) nichts miteinander zu tun haben.
|
Diese Hypothese versucht die Homochiralität auf molekularer Ebene aus der Paritätsverletzung auf der Ebene der Elementarteilchen zu erklären, und zwar auf folgende Weise: Beim b-Zerfall radioaktiver Atomkerne entstehen Elektronen, die aufgrund der Paritätsverletzung longitudinal polarisiert sind. Wenn diese Elektronen auf Materie treffen, so erzeugen sie circular polarisierte Bremsstrahlungs-Photonen. Diese wiederum könnten von organischen Molekülen absorbiert werden und stereoselektive synthetische oder abbauende Reaktionen auslösen, und zwar solche Reaktionen, die bekanntermaßen von circular polarisiertem Licht induziert werden. Netto würde – gemäß dieser Hypothese – auf abiotische Weise ein Enantiomerenüberschuß generiert.
Der erste Bericht über die angebliche Bestätigung dieser Theorie war eine Arbeit (Garay 1968), bei der Lösungen von D- bzw. L-Tyrosin getrennt der b-Strahlung des natürlich vorkommenden Strontium-Isotops der Masse 90 ausgesetzt wurden. Nach 18 Monaten war angeblich die Menge an D-Tyrosin geringer geworden gegenüber seinem L-Enantiomer. Garays Arbeit wird gelegentlich noch zitiert, obwohl seine Ergebnisse von anderen Arbeitsgruppen nicht nur nicht wiederholt werden konnten, sondern schon in den 1970er Jahren ernsthafte Zweifel am experimentellen Vorgehen und den Interpretationen Garays publiziert wurden (Bonner 1974). Bonner versuchte daraufhin, unter veränderten Bedingungen mittels b-Strahlung eine Anreicherung eines Enantiomers zu erzeugen. Unter anderem verwendete er auch eine wesentlich stärkere b-Strahlung (Bonner 1974). Jedoch gelang in allen Experimenten kein experimenteller Beweis, daß die Vester-Ulbricht-Hypothese etwas zur Erklärung des Ursprungs der Homochiralität beiträgt. Im Gegenteil wurde in anderen Experimenten gezeigt, daß Bestrahlung (mit b-Strahlen oder Selbstbestrahlung radioaktiver, 14C haltiger Proben) zu Radiorazemisierung führte, also geringe Enantiomeren-Überschüsse zerstört (Bonner 2000).
|
(2) Spontaner Symmetriebruch
Nach dieser Hypothese soll ein (statistisch extrem unwahrscheinliches, unbekanntes) Ereignis das Gleichgewicht irgendwann zugunsten des einen Enantiomeren verschoben haben: spontaner Symmetriebruch. Frank hat 1953 ein rein theoretisches Schema vorgestellt, bei dem durch asymmetrische Autokatalyse ein Enantiomer seine eigene Entstehung katalysiert, so daß es zu einer Verschiebung des Enantiomerenverhältnisses kommt. Da aber prinzipiell dasselbe umgekehrt für das andere Enantiomer gilt, es auch seine eigene Bildung katalysiert, sind beide weiterhin gleichberechtigt. Außerdem kann das Schema ebensogut das autokatalytische Verschwinden von Enantiomeren-Überschüssen voraussagen. Schließlich und endlich würden zufällige Fluktuationen in kleinen Molekülkollektiven durch ebensolche Fluktuationen in anderen kleinen Kollektiven aufgehoben. Konkrete Beispiele für asymmetrische Autokatalyse „funktionierten“ nur, weil man z.B. bei der Reaktionsdurchführung von einem Enantiomerenüberschuß ausging (z.B. Soai et al. 1995; Mathew et al. 2004) oder die eine Sorte chiraler Kokristalle zusetzte (Kawasaki et al. 2005a), oder aber man erhielt stochastisch in einer Reihe von Experimenten eine Anreicherung entweder des einen oder des anderen Enantiomers, in der Summe also keine Homochiralität (Soai et al. 2003; Singleton & Vu 2003; siehe Kasten Soai-Reaktion).
In einer Arbeit von Gleiser & Thorarinson (2006) werden Modellrechnungen dazu angestellt, ob bei Polymerisationsreaktionen unter präbiotischen Bedingungen das nachhaltige Auftreten von Homochiralität zu erwarten ist. Die Modellrechnungen zeigen aber, daß ein solcher Effekt nicht zu erwarten ist. Die Autoren beschließen Ihren Beitrag mit den vielsagenden Worten: „Thus, within the violent environment of prebiotic earth, effects from such sources, even if cumulative, would be negligible: any accumulated excess could be easily wiped out by any external disturbance.“ („Somit wären in der aufgewühlten Umgebung, die die präbiotische Erde war, Effekte von dieser Seite [Polymerisationsreaktionen] vernachlässigbar, auch wenn sie kumulativ wären. Jeder Überschuß, der sich angesammelt hätte, würde mit Leichtigkeit durch eine Störung von außen zunichte gemacht.“)
|
Eine gewisse Bekanntheit hat die Soai-Reaktion erworben (Soai et al. 1995). Sie besteht in der Addition einer zinkorganischen Verbindung an Aldehyde (Abb. 4). Ist das Produkt – ein Alkohol – asymmetrisch, können zwei Enantiomere entstehen. Soai stellte fest, daß autokatalytisch jedes Enantiomer seine eigene Entstehung fördert. Sorgt man experimentell dafür, daß zu Beginn ein Produkt-Enantiomer in geringem Überschuß vorliegt, so entsteht kein Racemat, sondern ein racemisches Gemisch, in dem entweder das eine oder das andere Enantiomer überwiegt. Man hat untersucht (Singleton & Vu 2003) und theoretisch analysiert (Islas et al. 2005), wie klein der initiale Überschuß eines Enantiomeren sein darf, damit ein meßbarer Überschuß im Produktgemisch auftritt. Die theoretische Untersuchung hilft nicht weiter, da sie numerisch simuliert, was zunächst einmal experimentell beobachtet werden müßte; im Grunde handelt es sich bei der Arbeit von Islas et al. 2005 um einen Spezialfall der Überlegungen von Frank (1953).
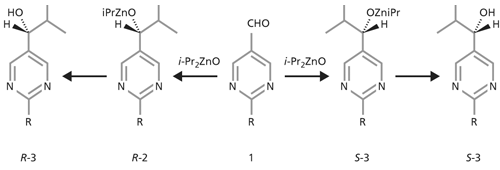 |
| Abb. 4: Die Soai-Reaktion: Addition von Diisopropylzink an einen 4-substituierten achiralen Aldehyd 1. Die chiralen, enantiomeren Zwischenprodukte R-2 und S-2 katalysieren jeweils ihre eigene Entstehung, so daß bei Vorliegen eines Überschusses eines der beiden überwiegend entweder der eine oder der andere chirale Alkohol 3 entstand. |
Interessanter ist die experimentelle Arbeit: Singleton & Vu (2003) haben die Soai-Reaktion 54mal durchgeführt und in der Hälfte der Fälle das eine, in der anderen Hälfte das andere Enantiomer angereichert gefunden. Wiederum ist also „netto“ keine Homochiralität entstanden. Sie schätzen, daß ca. 60.000 Moleküle den Ausschlag geben können, welches Enantiomer bei der Soai-Reaktion angereichert wird. Daraus schließen sie, daß es in der Erdgeschichte auch so gekommen sei. Eine oder mehrere bisher unbekannte präbiotische Reaktionen – die Soai-Reaktion selbst hat mit der Chemie des Lebens nichts zu tun – hätten ausgehend von einem kleinen Überschuß letztlich zur Entstehung der Homochiralität geführt. Diese Schlußfolgerung ist aber mehr als hypothetisch. Erstens haben Singleton & Vu (2003) – ebenso wie Soai und andere vor ihnen – in einem Schritt nur eine geringe Enantiomerenanreicherung herbeiführen können. Sie mußten mehrere gut überlegte, von den Experimentatoren kontrollierte Amplifizierungsschritte anhängen, um in die Nähe reiner Enantiomere zu kommen. Das postulierte Ziel war also wiederum nur unter Einsatz gezielter, planmäßiger, kreativer Experimentierkunst zu erreichen.
Zweitens bestätigt ihr Ergebnis eigentlich nur, daß eine relativ kleine Zahl von Molekülen das Produkt kontrolliert, was andere Evolutionsforscher im Bereich der präbiotischen Chemie schon lange vorher formuliert hatten: daß es zwar kleine Fluktuationen in Molekülensembles gibt, die Fluktuationen unter präbiotischen Bedingungen aber rasch verschwinden (Dose 1987), außer man arbeitet gezielt auf ein bestimmtes Resultat hin. In 54 Reaktionsansätzen entstand netto kein Enantiomerenüberschuß; denn jedes der beiden Enantiomere katalysiert seine eigene Entstehung. Da kleine Überschüsse jeweils genügen, passiert statistisch gleich oft das eine wie das andere.
|
Beispiel Kristallisation: Seit vielen Jahren ist bekannt (Harada 1970), daß aus übersättigten Lösungen von racemischen Gemischen entweder das eine oder das andere Enantiomer auskristallisiert, wenn man einen Kristall entweder des einen oder des anderen hinzufügt. Die Entstehung übersättigter Lösungen könnte in der Natur durchaus stattfinden bzw. präbiotisch stattgefunden haben (Dose & Rauchfuss 1975, Rauchfuss 2005). In einem präbiotischen Universum zufälliger chemisch-physikalischer Vorgänge würde aber gleich oft mal das eine, mal das andere auskristallisieren. „Netto“ liegt also auch hier kein chiraler Einfluß vor: die eventuelle Anreicherung des einen Enantiomeren hier wird durch die Anreicherung seines Spiegelbildes dort aufgehoben. Es wäre im wahrsten Sinne des Wortes ein Wunder, also ein nicht reproduzierbares, den chemischen und statistischen Gesetzen widersprechendes Ereignis, würde man glauben, die Kristallisation des einen Enantiomeren habe öfter stattgefunden als die des anderen. Es wäre auch falsch zu formulieren, das eine Enantiomer habe sich „durchgesetzt“. Präbiotisch besteht keine Konkurrenz von Molekülen, und in einer achiralen Umgebung hat kein Enantiomer einen Vorteil gegenüber einem anderen. Das auf biologischer Ebene wichtige Konkurrenz-Konzept funktioniert hier nicht. Wenn zum Beispiel behauptet wird, die a-Helix eines enantiomerenreinen Proteins habe den Vorteil, weniger leicht hydrolysiert zu werden, so gilt dasselbe für das ebenso existenzfähige Spiegelbild dieser a-Helix, die aus den spiegelbildlichen Aminosäuren zusammengesetzt ist. Wiederum sieht man zwei gleich wahrscheinliche Möglichkeiten vor sich und die chemische Erfahrung zeigt, daß eine Selektion durch externe Einflußgrößen (Randbedingungen, die der Chemiker gezielt wählt) erreicht werden kann.
Ganz prinzipiell (naturgesetzlich) sind immer die beiden „spiegelbildlichen“ Vorgänge gleich wahrscheinlich, gleich ob es sich um Reaktionen oder Kristallisationen handelt. Dasselbe gilt auch für die bevorzugte Adsorption eines Enantiomers an eine chirale Oberfläche (z.B. an Calcit- oder Quarzkristalle): Ohne Annahme eines außerhalb der bekannten Beobachtungen oder Naturgesetze liegenden Vorgangs wird es gleich viele spiegelbildliche chirale Oberflächen geben, von denen die eine das eine und die andere das andere Enantiomer adsorbiert und somit beide in gleichem Maße „angereichert“ werden.
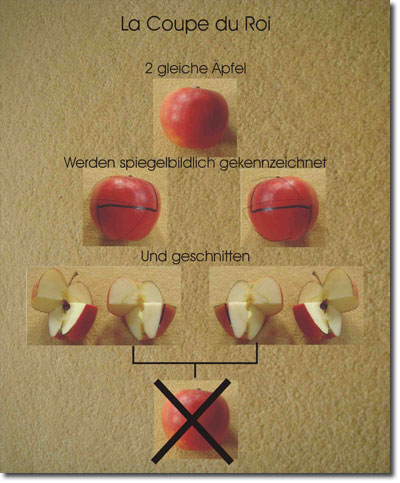 |
| Abb. 5: Der Coupe du Roi (königliche Schnitt), ein alter französicher Salontrick. Zwei Äpfel, die für perfekte Kugeln stehen, sollen jeweils in zwei gleiche Hälften zerschnitten werden, und zwar so, daß aus einer Hälfte des einen und einer des anderen Apfels kein Apfel zusammengesetzt werden kann. Die Hälften je eines Apfels sind homochiral, also chiral und identisch; die Hälften der beiden Äpfel sind zueinander spiegelbildlich (heterochiral), anders gesagt: Die Apfelhälften sind Enantiomere. Im Zusammenhang mit dem in diesem Artikel diskutierten Phänomen der Homochiralität gilt Folgendes: Würde man eine große Anzahl Äpfel in dieser Weise zerschneiden lassen, aber zufallsgesteuert im Hinblick auf Schnittrichtung und damit Chiralität, so ist es auszuschließen, daß alle Apfelhälften identisch wären. Vielmehr würden gleich viele heterochirale Apfelhälften resultieren, also ein Razemat. Die in der Natur beobachtete Homochiralität ist in der Tat sehr auffällig! In einer organisch-synthetischen Arbeit (Anet et al. 1983) wurde ein homochirales Molekül auf ähnliche Weise zu einem achiralen Molekül zusammengesetzt - sozusagen eine chemische Umkehr des Coupe du Roi. |
|
Manche Publikationen verlegen den Vorgang der Zersetzung eines Enantiomeren durch eine physikalische Einflußgröße in den interstellaren Raum. In der Vergangenheit wurde circular polarisiertes Licht diskutiert. Mindestens zwei Gründe sprechen dagegen: erstens, daß die im Labor unter kontrollierten Bedingungen erreichbaren Überschüsse in einem Bereich lagen, der durch natürliche Racemisierungsprozesse wieder verschwände (Dose 1987), zweitens weil es auch im interstellaren Raum gleichermaßen links- und rechts-circular polarisiertes Licht gibt, wenn man nicht an Phänomene außerhalb des Rahmens grundlegender Naturgesetzlichkeit glaubt. Die bisher gefundenen geringen Überschüsse von Enantiomeren durch circular polarisiertes Licht werden nach Meierhenrich et al. 2005 dadurch verursacht, daß man mit Lösungen von Racematen experimentiert hat. Mit der Vermutung, im interstellaren Raum seien Lösungen biochemisch relevanter Moleküle, z.B. Aminosäuren, unwahrscheinlich, haben sie den Einfluß circular polarisierten Lichtes auf feste Aminosäuren untersucht. (Dabei wird vorausgesetzt, daß die benötigten Aminosäuren im interstellaren Raum in ausreichender Konzentration vorliegen.) Die Bestrahlung von festen Proben von racemischem Leucin mit rechts-circular polarisiertem Synchrotronlicht bei 182 nm erzeugte einen Enantiomerenüberschuß des D-Enantiomers von 2.6%. Auch hier bleibt die Frage: Wieso sollte im interstellaren Raum entweder rechts- oder links-circular polarisiertes Licht bevorzugt eingewirkt haben? Beides ist natürlicherweise gleich wahrscheinlich und gleich häufig! Denn Meierhenrich et al. schreiben selbst: „Bei entgegengesetzter Helizität der Photonen ... sollten entgegengesetzte Enantiomerenanreicherungen resultieren.“ Und in der Tat fanden sie entgegengesetzte Anreicherungen, je nachdem, ob mit links- oder rechts-circular polarisiertem Licht gearbeitet wurde. Den geringen Anreicherungsunterschied interpretieren sie mit kleinen Unterschieden und Unvollkommenheiten der Versuchsanordnung. Es gilt jedoch wiederum zu beachten: in der Natur sind ohne regelnden Eingriff naturgesetzlich beide „spiegelbildlichen“ Vorgänge gleich wahrscheinlich.
Die Thematik außerirdischer Einflußgrößen soll im Folgenden kurz zusammenfassend behandelt werden.
(3) Ursprung der Homochiralität von außen
Diese Hypothese besagt, die auf der Erde beobachtete Homochiralität sei von außen eingetragen worden. So hat man auf manchen Meteoriten Enantiomerenüberschüsse von bis zu 9% gefunden – freilich nur zweier nicht-proteinogener Aminosäuren (Cronin & Pizzarello 2004). Das löst das Problem nicht, sondern verschiebt es nur, es sei denn man wollte postulieren, daß außerhalb der Erde die hier beobachteten chemisch-physikalischen Gesetzmäßigkeiten nicht gälten. Daß es diese Erklärungsversuche überhaupt gibt, zeigt, daß man sich bisher schwer tut mit einem Verständnis des Phänomens der Homochiralität innerhalb des naturwissenschaftlichen Beobachtungs- und Gesetzesraums.
(4) Beeinflussung von Enantiomeren durch elektromagnetische Felder
Nach dieser Hypothese hat ein physikalischer Einfluß die Entstehung oder Zersetzung des einen Enantiomeren begünstigt. Als mögliche Einflußgröße wird seit langem immer wieder ein Magnetfeld versucht oder diskutiert. Das geht auf ein oft falsch verstandenes Experiment Faradays aus dem Jahr 1846 zurück. Er ließ ein Magnetfeld auf linear polarisiertes Licht einwirken. Die Ebene des Lichtes wurde dadurch gedreht. Da eine Lösung eines reinen Enantiomeren ebenfalls die Ebene des linear polarisierten Lichtes dreht, wurde von manchen Wissenschaftlern der physikalisch nicht haltbare Schluß gezogen, das eine Phänomen (Faradays magnetooptische Rotation) sei die Ursache des anderen (natürliche optische Rotation).
|
Am Beispiel einer konkreten Arbeit soll der Sachverhalt folgend im Detail diskutiert werden. Diese Arbeit begeht nicht den Fehler, einen achiralen physikalischen Einfluß für die Entstehung molekularer Chiralität benutzen zu wollen. Vielmehr nutzt sie den magnetochiralen Dichroismus (= magnetochirale Anisotropie), der 1982 vorhergesagt (Wagnière & Meier 1982) und 1997 beobachtet wurde (Rikken & Raupach 1997). Unter Dichroismus versteht man eine richtungsabhängige Absorption von Licht. Beim magnetochiralen Dichroismus wird ein Lichtstrahl parallel oder antiparallel zu einem Magnetfeld durch eine Lösung chiraler Moleküle geleitet. Das Licht wird jeweils unterschiedlich stark absorbiert. Der Effekt tritt auch mit nicht polarisiertem Licht auf.
Abb. 6 zeigt die chemische Reaktion, bei der mittels des beschriebenen Effektes ein kleiner Überschuß des einen oder anderen Enantiomeren (4 und 5) erzeugt wurde. Es handelt sich um eine lichtkatalysierte Umlagerung des Chrom(III)trisoxalat-Komplexes. Der Komplex ist kinetisch instabil, d.h. er zerfällt und entsteht rasch wieder neu. Da er helikal chiral ist, d.h. wie ein Propeller oder eine Schraube gebaut, kann er in zwei enantiomeren Formen (4 und 5) vorliegen. In Abhängigkeit von der Richtung des angelegten Magnetfeldes relativ zum katalysierenden Laser-Lichtstrahl entstand das eine oder das andere Enantiomer bevorzugt. Der Enantiomerenüberschuß persistierte so lange, bis das Magnetfeld oder der Laser abgeschaltet wurden; dann relaxierte das System wieder zum Racemat.
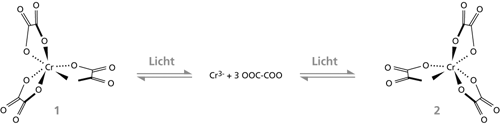 |
| Abb. 6: Lichtkatalysierte Umlagerung der enantiomeren Chrom(III)-Komplexe 4 und 5. |
|
Ist damit eine plausible Erklärungsmöglichkeit für die natürliche Homochiralität gefunden? Eine genaue Analyse der Vorgänge zeigt, daß das nicht der Fall ist.
(a) Der beobachtete Effekt kann bei Kohlenstoff-Verbindungen (die Moleküle des Lebens!) nicht auftreten. Der Chrom-Komplex wurde gewählt, weil er paramagnetisch und chiral ist. Aufgrund seines Paramagnetismus konnte man bei ihm erwarten, einen meßbaren Effekt zu erhalten. Diamagnetische (die meisten Kohlenstoff-Verbindungen!) bzw. achirale Moleküle können prinzipiell und naturgesetzlich in diesem Experiment nicht ansprechen.
b) Der Enantiomerenüberschuß war sehr klein – ähnlich klein wie bei Experimenten, wo man mit circular polarisiertem Licht Enantiomerenüberschüsse erzeugt hat (z.B. Stevenson & Verdieck 1969). Noch geringer wäre übrigens ein – bisher nur theoretisch diskutierter – Überschuß aufgrund der elektroschwachen Kraft (Bonner 2000). Wie schon zitiert (Dose 1987), gilt für alle drei physikalischen Kräfte, die zur Erklärung der Entstehung der Homochiralität herangezogen werden, daß jedes geringfügige Vorherrschen von D- oder L-Formen in einer geologischen Umgebung durch Razemisierungsreaktionen wieder aufgehoben würde.
(c) Rikker & Raupach betonen, daß polarisiertes Licht für das Zustandekommen des Effektes nicht notwendig war, sondern „normales“ Licht ausreichte. Zwei andere nichttriviale Anforderungen waren aber nötig: Erstens wurde nicht wirklich „normales“ Licht eingesetzt, sondern ein Laser, und zwar mit der Wellenlänge des Absorptionsmaximums des Chromkomplexes – keine selbstverständlichen Gegebenheiten einer eventuellen präbiotischen Welt. Zweitens hatte das verwendete Magnetfeld eine Feldstärke von 7,5 Tesla. Die mittlere Feldstärke des Erdmagnetfeldes, gemessen an der Erdoberfläche, beträgt am Äquator etwa 0,032 Nanotesla, d.h. das im Experiment eingesetzte Feld war etwa 234 Milliarden mal stärker als das gegenwärtige, in der Natur vorgefundene. Es ist auszuschließen, daß auf der Erde einmal ein auch nur annähernd so starkes Feld geherrscht haben könnte. Bei schwächeren Feldern wäre jedoch eine eventuelle Enantiomerenanreicherung praktisch nicht mehr gegeben.
(d) Aber vielleicht hat es irgendwo ein lokal begrenztes, sehr starkes Feld gegeben, und ein einmal entstandener Enantiomerenüberschuß hat sich von dort aus durchgesetzt? Diese Hypothese führt uns zur letzten kritischen Anmerkung. Der magnetochirale Dichroismus ist in der Tat eine chirale Einflußgröße im Sinne der gegenwärtig akzeptierten Definition von Chiralität, die im Unterschied zur Definition Kelvins eine Zeitumkehr und damit auch bewegungsabhängige Prozesse (Molekül- und Reaktionsdynamik) einschließt (Avalos et al. 1998). Der magnetochirale Effekt ist aber – wie in der diskutierten Arbeit gezeigt – umkehrbar. Das bedeutet: Wenn Lichtstrahl und Magnetfeld parallel sind, entsteht bevorzugt das eine Enantiomer; wenn sie antiparallel sind, sein Spiegelbild. In einem präbiotischen Universum zufälliger chemisch-physikalischer Vorgänge wäre nun mal die eine, mal die andere relative Orientierung vorzufinden. „Netto“ liegt also auch hier kein chiraler Einfluß vor: die eventuelle Anreicherung des einen Enantiomeren hier wird durch die Anreicherung seines Spiegelbildes dort aufgehoben. Man müßte zusätzlich spekulieren, das magnetochirale Ereignis habe nur an einer Stelle einmal stattgefunden mit nur einer relativen Anordnung der Felder – eine Spekulation, die jenseits aller Erfahrung, Beobachtung und Wahrscheinlichkeit liegt.
|
Auf der Basis dieses Irrtums versuchte beispielsweise Pasteur homochirale Kristalle in einem Magnetfeld zu züchten – erfolglos. Lord Kelvin stellte schon klar, daß „der magnetischen Rotation [Faradays Experiment] die Eigenschaft der Links- oder Rechtshändigkeit fehlt, sie also nicht chiral ist“ (Kelvin 1904).
Faradays und Kelvins Klarstellungen konnten nicht verhindern, daß immer wieder versucht wurde, mittels eines Magnetfeldes einen Enantiomerenüberschuß zu erzeugen. Der bekannteste Versuch dieser Art war eine Arbeit (Zadel et al. 1994), die sich als bewußte Fälschung eines wissenschaftlichen Mitarbeiters herausstellte (Gölitz 1994). Nach dem Erscheinen dieser Arbeit und noch vor dem Bekanntwerden als Fälschung hatte es einen Kommentar gegeben, der die physikalische Unmöglichkeit der Ergebnisse klarstellte (Bradley 1994). Knapp und anschaulich gesagt: Ein noch so starkes Magnetfeld ist ebensowenig in der Lage, eine chemische Reaktion in Richtung eines Enantiomeren zu drücken wie ein Blatt von einem Baum zu lösen.
Aber auch tatsächlich chirale Einflußgrößen wie circular polarisiertes Licht oder der magnetochirale Dichroismus geben keine Erklärung für die natürliche Homochiralität. Entweder wurden Beispielreaktionen veröffentlicht, die nichts mit chiralen Bausteinen der Lebewesen zu tun haben oder es wurde z.B. ein Magnetfeld in einer für natürliche Bedingungen ganz unrealistischen Feldstärke eingesetzt. Vor allem jedoch mußte stets postuliert werden, daß die chirale Einflußgröße nur in der einen „spiegelbildlichen“ Weise aktiv war. Aber für mögliche physikalische Einflußgrößen gilt genau wie für Enantiomere, daß sie in beiden chiralen Formen gleichberechtigt auftreten. „Netto“ liegt also kein chiraler Einfluß vor; die eventuelle Anreicherung des einen Enantiomeren hier wird durch die Anreicherung seines Spiegelbildes dort aufgehoben.
 |
Wir wissen, wie man reine Enantiomere
herstellen kann – von allein, d. h.
de novo, ohne Vorgabe von Leben,
geschieht es nicht. |
 |
|
So bringt auch die Kombination der asymmetrischen Autokatalyse und des circular polarisierten Lichtes (Kawasaki et al. 2005b) keinen Erklärungsfortschritt, da wiederum beide Möglichkeiten bzw. Kombinationen gleichberechtigt und gleich wahrscheinlich sind. In der Arbeit von Kawasaki et al. (2005b) wurde das auch explizit im Experiment gezeigt, daß nämlich mit circular links-, dann rechtspolarisiertem Licht und jeweils nachfolgender asymmetrischer Autokatalyse einmal das eine, einmal das andere Enantiomer entstand.
An dem im Kasten „Enantiomerenanreicherung durch magnetochiralen Dichroismus?“ detailliert diskutierten Beispiel des magnetochiralen Dichroismus wird das grundsätzliche Problem naturalistischer Erklärungsversuche der Homochiralität offensichtlich. Die Erklärungen fordern eine Häufung notwendiger, auf der heutigen Erde nirgendwo vorgefundener Voraussetzungen. Das verringert die Plausibilität dramatisch. Rikker & Raupach formulieren am Ende ihres Artikels: „Clearly, the question of the origin of the homochirality of life is far from answered.“ („Die Frage nach dem Ursprung der Homochiralität des Lebens ist weit davon entfernt, beantwortet zu sein.“) Dieser Befund aus dem Jahr 1997 gilt nach wie vor und findet sich auch in neuesten Fachpublikationen, z.B. Meierhenrich et al. 2005: „Das Phänomen der biomolekularen Asymmetrie, wonach proteingebundene Biomoleküle wie Aminosäuren dieselbe Chiralität haben, bedarf nach wie vor der Erklärung.“ Dennoch wird in stark verkürzten und popularisierenden Veröffentlichungen manchmal etwas anderes behauptet. Diese Behauptungen enthalten in der Regel eine schlagwortartige Aufzählung von chemischen oder physikalisch-chemischen Phänomenen, die angeblich alle zur Entstehung von Enantiomerenüberschüssen führen. In Wirklichkeit handelt es sich um die hier und in sehr ausführlichen Übersichtsartikeln (z.B. Bonner 1996, Bonner 2000) besprochenen Phänomene, deren keines das Rätsel der Homochiralität löst. Der Ursprung der für Leben notwendigen Homochiralität ist mit naturalistischen Prämissen nicht erklärt.
|
|
Schlußfolgerung
Das Phänomen der Homochiralität wird aber sofort verständlich, wenn wir nicht auf der Basis unseres Nicht-Wissens, sondern unseres Wissens an die Fragestellung herangehen. Wir wissen sehr genau, wie man reine Enantiomere und überhaupt die Moleküle des Lebens (Aminosäuren, Zucker, Proteine, RNS, DNS usw. usf.) herstellen kann, unter welchen Bedingungen sie entstehen können, stabil sind oder zerfallen. Wir wissen auch, unter welchen Bedingungen sie eben nicht entstehen können. Wir können sie selbst herstellen und sehen, welche Chemie dafür erforderlich ist und welche es verhindert. Wir wissen, daß beispielsweise reine Enantiomere nicht von allein entstehen, sondern mittels gezielter Auswahl von Reagenzien, Reaktionsbedingungen, Reaktionsaufarbeitung und -abfolgen durch einen Experimentator.
Auf der Basis dieses unseres Wissens können wir schließen, daß auch die erste Entstehung der Moleküle des Lebens und ihr Zusammenbau zu einer Zelle gezielte Planung und Kreativität erforderte. Zielsetzung, Planung und Kreativität sind hier nicht „Lückenbüßer“ für etwas (noch) Unverstandenes, sondern logische Folgerung aus unserem experimentellen, in unzähligen Versuchen wissenschaftlich erworbenen Wissen um die Eigenschaften und Erfordernisse für die Moleküle des Lebens und für lebende Zellen. Die vorliegende Erfahrung aus der Chemie zeigt, daß es dafür absolut notwendig und unerläßlich ist, gezielt und geplant vorzugehen.
Die beste Erklärung für die Entstehung der Homochiralität ist also diejenige, die auf unserem Wissen um die Möglichkeiten der Entstehung dieses Phänomens basiert statt auf Spekulationen und Hypothesen. Die beste Erklärung ist: Jemand – ein Schöpfer – hat „manipuliert“, so wie es auch Chemikern durch kreative, gezielte Versuchsplanung und -durchführung gelingt, enantiomerenreine Substanzen herzustellen. Wir wissen, wie man reine Enantiomere herstellen kann – von allein, d. h. de novo, ohne Vorgabe von Leben, geschieht es nicht. Deshalb kann es nach allem, was wir wissen, auch „ganz am Anfang“ nicht von allein geschehen sein. Von nichts kommt nichts (Imming 2005).
|
Literatur
- Anet FAL, Miura SS, Siegel leJ & Mislow K (1983)
- La Coupe du Roi and Its Relevance to Stereochemistry. J. Am. Chem. Soc. 105, 1419-1426.
- Avalos M, Babiano R, Cintas P, Jimenez JL, Palacios JC & Barron LD (1998)
- Absolute Asymmetric Synthesis under Physical Fields: Facts and Fictions. Chem. Rev. 98, 2391-2404.
- Bonner WA (1974)
- Experiments on the origin of molecular chirality by parity non-conservation during b-decay. J. Mol. Evol. 4, 23-39.
- Bonner WA (1996)
- The quest for chirality. In: Cline DB, editor. Physical origin of homochirality in life. Woodbury, NY: American Institute of Physics, p. 17-49.
- Bonner WA (2000)
- Parity violation and the evolution of biomolecular homochirality. Chirality 12, 114-126.
- Bradley D (1994)
- A new twist in the tale of nature’s asymmetry. Science 264, 908.
- Cline DB (Hg.) (1996)
- Physical origin of homochirality in life. American Institute of Physics, Woodbury, New York (Air conference proceedings 379)
- Cronin JR & Pizzarello S (1997)
- Enantiomeric excesses in meteoritic amino acids. Science 275, 951-955.
- Dose K (1987)
- Präbiotische Evolution und der Ursprung des Lebens. Chemie in uns. Zeit 21, 177-185.
- Dose K & Rauchfuss H (1975)
- Chemische Evolution und der Ursprung lebender Systeme. Stuttgart.
- Feringa BL & van Delden RA (1999)
- Absolute asymmetrische Synthese: Ursprung, Beeinflussung und Verstärkung von Chiralität. Angew. Chem. 111, 3624-3645.
- Frank FC (1953)
- Spontaneous asymmetric synthesis. Biochim. Biophys. Acta 11, 459-463.
- Garay AS (1968)
- Origin and role of optical isomery in life. Nature 219, 338-340.
- Gleiser M & Thorarinson J (2006)
- Prebiotic homochirality as a critical phenomenon. arXiv:astro-ph/0601399 v1, 18 Jan 2006.
- Gölitz P (1994)
- Enantioselektive Reaktionen im statischen Magnetfeld? – Falscher Alarm! Angew. Chem. 106, 1525.
- Harada K (1970)
- Origin and development of optical activity of organic compounds on the primordial earth. Naturwissenschaften 57, 114-119.
- Imming P (2005)
- Von nichts kommt nichts. In: Ullrich H (Hg) Mit Kopf und Herz. Holzgerlingen, S. 139-150.
- Islas JR, Lavabre D, Grevy JM, Lamoneda RH, Cabrera HR, Michaeu JC & Buhse H (2005)
- Mirror-symmetry breaking in the SOAI reaction: a kinetic understanding. Proc. Natl. Acad. Sci. USA 102, 13743-13748.
- Kawasaki T, Jo K, Igarashi H, Sato I, Nagano M, Koshima H & Soai K (2005a)
- Asymmetric amplification using chiral cocrystals formed from achiral organic molecules by asymmetric autocatalysis. Angew. Chem., Internat. Ed. 44, 2774-2777.
- Kawasaki T, Sato M, Ishiguro S, Saito T, Morishita Y, Sato I, Nishino H, Inoue Y & Soai K (2005b)
- Enantioselective Synthesis of Near Enantiopure Compound by Asymmetric Autocatalysis Triggered by Asymmetric Photolysis with Circularly Polarized Light. J. Am. Chem. Soc. 127, 3274-3275.
- Lord Kelvin (1904)
- Baltimore Lectures on Molecular Dynamics and the Wave Theory of Light. CJ Clay and Sons, London.
- Kleemann A, Engel J, Kutscher B & Reichert D (2001)
- Pharmaceutical Substances. Stuttgart: Thieme Verlag.
- Mathew SP, Iwamura H & Blackmond DG (2004)
- Amplification of enantiomeric excess in a proline-mediated reaction. Angew. Chem. 116, 3379-3383.
- Meierhenrich UJ, Nahon L, Alcaraz C, Bredehöft JH, Hoffmann SV, Barbier B & Brack A (2005)
- Asymmetrische Vakuum-UV-Photolyse der Aminosäure Leucin in fester Phase. Angew. Chem. 117, 5774-5779.
- Rauchfuss H (2005)
- Chemische Evolution und der Ursprung des Lebens. Berlin.
- Rikken GLJA & Raupach E (1997)
- Observation of magneto-chiral dichroism. Nature 390, 493-494.
- Singleton DA & Vu LK (2003)
- A few molecules can control the enantiomeric outcome. Evidence supporting absolute asymmetric synthesis using the Soai asymmetric autocatalysis. Org. Lett. 5, 4337-4339.
- Soai K, Shibata T, Morioka H & Choji K (1995)
- Asymmetric autocatalysis and amplification of enantiomeric excess of a chiral molecule. Nature 378, 767-768.
- Soai K, Sato I, Shibata T, Komiya S, Hayashi M, Matsueda Y, Imamura H, Hayase T, Morioka H, Tabira H, Yamamoto J & Kowata Y (2003)
- Asymmetric synthesis of pyrimidyl alkanol without adding chiral substances by the addition of diisopropylzinc to pyrimidine-5-carbaldehyde in conjunction with asymmetric autocatalysis. Tetrahedron Asymmetry 14, 185-188.
- Stevenson KL & Verdieck JF (1969)
- Partial photoresolution II. Application to some chromium complexes. Mol. Photochem. 1, 271-288.
- Wagnière G & Meier A (1982)
- The influence of a static magnetic field on the absorption coefficient of a chiral molecule. Chem. Phys. Lett. 93, 78-81.
- Zadel G, Eisenbraun C, Wolff GJ & Breitmaier E (1994)
- Enantioselektive Synthese im statischen Magnetfeld. Angew. Chem. 106, 460-463.
|
|  |
