|
Circadiane Uhren bestimmen den Tagesrhythmus von Lebewesen. Der Oszillator besteht aus einem Netzwerk von drei Proteinen, deren Menge durch Rückkopplung periodisch ansteigt bzw. abfällt. Neuere Untersuchungen lassen vermuten, daß sich die drei Proteine zu einer drehbaren Einheit zusammenfügen und so die Geschwindigkeit der Rückkopplung regulieren – ein ausgeklügeltes System!
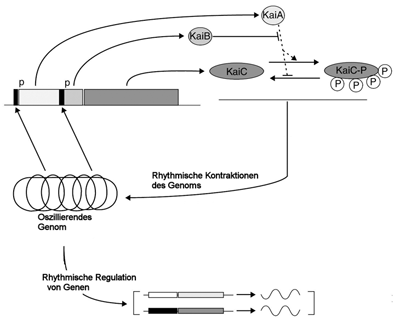 |
| Abb. 1: Das Gencluster der kai-Gene (links oben) führt zur Produktion von Kai-Proteinen (rechts), die sich gegenseitig hemmen oder aktivieren. Dies stellt das Herzstück der Uhr dar und es reguliert die Auf- bzw. Abwicklung des Chromosoms im Takt der Uhr (links unten), welches wiederum die Produktion von den Kai-Proteinen selbst, aber auch mehr oder weniger allen anderen Genen beeinflußt. (Nach Johnson 2004) |
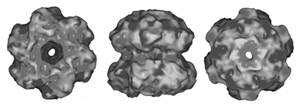 |
| Abb. 2: Die Ringstruktur von KaiC. In das Loch wird KaiA eingeführt, worauf sich KaiC dreht. (Aus Wang 2005) |
|
Die verstrichene Zeit zu messen ist nicht nur für Menschen wichtig, auch andere Lebewesen sind darauf angewiesen. Viele Lebewesen tragen dabei „innere Uhren“, die circadian genannt werden. Dies kommt aus dem lateinischen für circa = ungefähr, und dies = Tag, denn die biologischen Uhren haben eine Zeitkonstante von etwa 24h. Die meisten Uhren menschlicher Bauart arbeiten mit Oszillatoren, sei es das Pendel bei einer alten Standuhr, der Schwingquarz in einer Armbanduhr oder die Mikrowellenstrahlung von Cäsiumatomen bei der Atomuhr. Cyanobakterien (früher Blaualgen genannt) benutzen einen biochemischen Oszillator, der neueren Erkenntnissen zufolge vermutlich mit drehbaren Teilen ausgestattet ist.
Die circadiane Uhr der Cyanobakterien bestimmt die Genregulation interessanterweise global, d.h. mehr oder weniger alle Gene werden beeinflußt. In anderen Lebewesen wird nur ein Teil der Gene von der inneren Uhr gesteuert. Bei der globalen Steuerung aller Gene wird das Erbgut (Chromosom) im Rhythmus der Uhr auf- oder abgewickelt. Dadurch werden die Steuerungsregionen für die einzelnen Gene entweder gesperrt oder besser zugänglich und dadurch letztlich reguliert.
Der Oszillator der cyanobakteriellen Uhr besteht im wesentlichen aus drei Proteinen, deren Gene hintereinander auf dem Chromosom liegen. Sie werden KaiA, KaiB und KaiC genannt (nach japanisch kai = Zyklus). KaiC ist dabei die „Ausgabeeinheit“, die das Zeitsignal weitergibt. KaiC versieht sich dabei selbst rhythmisch mit Phosphatgruppen bzw. spaltet diese wieder ab. Diese Phosphorylierung wird von KaiA befördert, die Abspaltung der Phosphatgruppen gleichzeitig gehemmt. KaiB wiederum hemmt KaiA. Über den Mechanismus der Auf- bzw. Abwicklung des Erbguts, vermittelt durch phosphoryliertes KaiC, werden die Gene kaiB und kaiC ebenfalls rhythmisch abgelesen, während die Menge an KaiA kaum schwankt. Das geschilderte und stark vereinfachte Wechselspiel biochemischer Vorgänge ist so eingestellt, daß es einen vollen Kreislauf einmal am Tag durchläuft, auch wenn die Zellen sich in dieser Zeit mehr als einmal teilen (Abb. 1).
Der ablaufende Zyklus ist erstaunlich stabil (über Monate), aber in der Regel etwas länger als 24 Stunden, wenn man die Zellen bei Dauerlicht hält. Andere Proteine, die mit den Kai-Proteinen interagieren, reagieren auf sich ändernde Lichtintensitäten, wodurch die Uhr der tatsächlichen Tageslänge angepaßt wird. Auch die eingebaute Temperaturkompensation wird über verschiedene weitere Regelkreise ermöglicht.
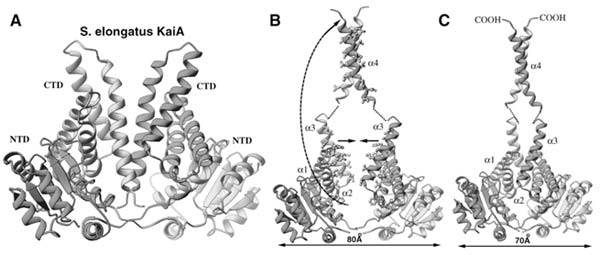 |
| Abb. 3: Das KaiA-Protein. A) Zwei KaiA-Einheiten interagieren miteinander. B) Durch Wechselwirkungen wird die spätere Nabe für KaiC ausgeklappt und die Moleküle rücken näher zusammen. C) Das aktivierte KaiA ist bereit, einen Ring aus KaiC-Einheiten zu empfangen. (Aus Wang 2005) |
|
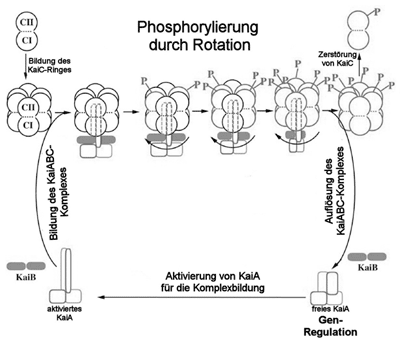 |
| Abb. 4: Der Oszillator im Überblick: KaiC-Einheiten lagern sich zu einer ringförmigen Struktur, die auf dem aktivierten KaiA Platz findet und durch KaiB gesichert wird. KaiC dreht sich auf KaiA und wird dabei mit Phosphorgruppen versehen. Sind alle Stellen mit Phosphor besetzt, löst sich KaiC ab und wird zerstört. KaiB trennt sich ebenfalls von KaiA, welches dadurch deaktiviert wird. Dieser Prozeß wird mehrfach durchlaufen, bis ein bestimmter Schwellenwert an freiem KaiA in der Zelle überschritten wird. Danach wird neues KaiC produziert und der gesamte Zyklus wiederholt sich. (Nach Wang 2005) |
|
In 2005 wurde von Jimin Wang ein neues Modell vorgeschlagen, durch welches die Wechselwirkungen der einzelnen Kai-Proteine miteinander elegant erklärt werden könnte: Dabei bildet KaiC einen Doppelring mit je sechs Einheiten pro Ring (Abb. 2). Bei KaiA finden sich zwei Einheiten zusammen. Durch eine komplexe Wechselwirkung der beiden KaiA-Einheiten miteinander wird ein Stück des Proteins wie ein Finger ausgeklappt (Abb. 3). Auf diesen Finger setzt sich der Ring aus den insgesamt 12 KaiC-Einheiten. KaiC kann nun auf KaiA rotieren und bei jeder 120°-Rotation wird eine KaiC-Einheit phosphoryliert. Sind alle KaiC-Einheiten mit Phosphor besetzt, zerfällt der Komplex aus KaiC und KaiA wieder in seine Einzelteile und das phosphorylierte KaiC wird abgebaut. Wie oben beschrieben hemmt KaiB das KaiA. Dieses klemmt sich anscheinend zwischen KaiC und KaiA und behindert die Rotation des KaiC-Ringes auf dem KaiA-Finger, welches im Ergebnis wie eine KaiA-Hemmung aussieht. Den Anstoß für die neuerliche Genexpression liefert nun nicht phosphoryliertes KaiC wie im alten Modell, sondern das freigesetzte KaiA.
Das auf den ersten Blick Faszinierende ist dabei, daß die Uhr dieser vergleichsweise einfachen Organismen drehbare Teile aufweist. Räder bzw. drehbare molekulare Maschinen sind in der Natur nur selten zu finden: Die ATPase, welche die zelluläre Energieeinheit ATP herstellt, dreht sich mit Hilfe von durchlaufenden Protonen auf einem Zapfen und die Änderungen in der Form während einer Drehung katalysieren aus ADP und Phosphor ATP. Gleichermaßen Protonen als „Strom“ verbraucht der bakterielle Elektromotor, der die Flagellen und somit das Bakterium antreibt. Sollte die Hypothese von Wang über die cyanobakterielle Uhr bestätigt werden, wäre dies das dritte Beispiel einer rotierenden Maschine. Dabei darf man den KaiC-KaiA-Komplex aber keinesfalls mit einem Zahnrad oder dergleichen aus einer mechanischen Uhr vergleichen. Es handelt sich aber einen eleganten Mechanismus, der sicherstellt, daß mit einer bestimmten Geschwindigkeit (eben 24 Stunden) KaiA freigesetzt wird, damit es andere Gene regulieren kann. Dabei muß man bedenken daß es einige Tausend solcher Komplexe in einer Zelle gibt, die mehr oder weniger zur selben Zeit eine gewisse Menge an freiem KaiA bereitstellen. Ist ein bestimmter Schwellenwert von freiem KaiA erreicht, werden nachfolgend Prozesse in Gang gesetzt, die wieder neues KaiC herstellen, damit der Zyklus erneut durchlaufen werden kann. Man könnte den Vorgang als eine mechanische Verlangsamung eines biochemischen Vorgangs betrachten, um die erwünschte Frequenz zu erreichen (Abb. 4).
|
