 |
Regulation der Tagesrhythmik bei Organismen weit entfernter Taxa von Wolfgang B. Lindemann
Studium Integrale Journal
9. Jahrgang / Heft 1 - Mai 2002
Seite 43 - 46
|
|
Viele biologische Vorgänge verlaufen nicht kontinuierlich, sondern periodisch. Es gibt kurzperiodische Vorgänge wie Zilienschlag, Aktionspotentiale von Nervenzellen oder der Herzschlag. Lange, meist jährliche Perioden sind Winterschlaf oder das jährliche Wandern von Zugvögeln oder Fischen wie z. B. Lachsen. Mittelperiodische Vorgänge sind Gezeitenrhythmen von Organismen im Wattenmeer oder die Schlaf-Wach-Rhythmen.
Von vielen Organismen sind regelmäßige Änderungen physiologischer Vorgänge bekannt, so bei Bakterien (SCHMITZ 2000), Pflanzen (PARK 1999, STRAYER 2000), Pilzen (LEE 2000) und Tieren wie Zebrafischen (DELAUNEY 2000), der Fruchtfliege Drosophila melanogaster (CERIANI 1999, SHAW 2000), Mäusen (HARDIN 1999, BARINAGA 1999), Hamstern (LOWREY 2000) und Ratten (YAMAZAKI 2000), nicht zuletzt auch beim Menschen (BILLIARD 1998, siehe auch hier für andere physiologische und klinische Daten für menschliche zirkadiane Rhythmen und Erkrankungen des Schlaf-Wach-Rhythmus). Bei Menschen und Säugern schwanken Körpertemperatur, Blutdruck, Hormonsekretion und viele andere Variablen während der 24 Stunden eines Tages. Man spricht von zirkadianen Rhythmen.
In diesem Beitrag sollen die zirkadianen Uhren der Fruchtfliege Drosophila melanogaster und der Maus beschrieben und miteinander verglichen und die Bedeutung dieser Erkenntnisse für die Ursprungsforschung diskutiert werden.
|

|
Die Fruchtfliege Drosophila melanogaster ist einer der am häufigsten untersuchten Modellorganismen, dessen Genom in nächster Zeit vollständig sequenziert sein wird. Auch Drosophila schläft zeitweise, das heißt es gibt einen beobachtbaren, regelmäßig wiederkehrenden Zustand, der stark dem ähnelt, was bei Säugetieren als Schlaf bezeichnet wird. Bei Säugern wird Schlaf meist definiert als ein Zustand vorübergehender Inaktivität, in einer artspezifischen Haltung, gekoppelt mit Bewußtlosigkeit, einer typischen Gehirnstrom-Kurve (EEG) und einer Schwellenstärke, die ein Reiz haben muß, damit das Tier diesen Zustand verlassen kann. Bei Säugern und Menschen ist das EEG entscheidend, um Beginn und Tiefe des Schlafes zu bestimmen. Offensichtlich kann diese Definition nicht bei Insekten der Größe wie Drosophila angewendet werden; namentlich ist es schwierig, von „bewußtem Verhalten“ zu sprechen. Zudem ähneln die elektrischen Ströme eines Insektengehirns nicht einem menschlichen oder einem Säuger-EEG. In einer kürzlich publizierten Studie (SHAW 2000) wurde allerdings gezeigt, daß es einen schlafähnlichen Zustand bei Drosophila gibt: Schlaf bei Drosophila ist charakterisiert durch eine erhöhte Reizschwelle, ist homöostatisch reguliert und unabhängig von der zirkadianen Uhr. Wie bei Säugern schlafen junge Fliegen mehr als alte, und Stimulantien bzw. Hypnotika sind wirksam.
Jedenfalls sind 24-Stunden-periodische Änderungen der Aktivität von Drosophila erkennbar, sowie Schwanken von Genexpression, Hormonsekretion oder anderer physiologischer Parameter, die auch bei Tierhaltung in konstanter Dunkelheit ohne äußere Zeitgeber erhalten bleiben. Die Folgerung, es gebe eine interne Uhr bei Drosophila, ist also offensichtlich. In den letzten Jahren wurden die Komponenten und die Funktion dieser inneren Uhr von Drosophila aufgeklärt (Abb. 1).
| |
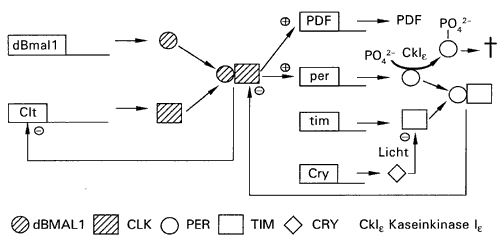 |
| Abb. 1: Die Drosophila-Uhr. Näheres im Text. | |
Spät in der Nacht wird das Gen clk aktiviert, das das CLOCK-Protein codiert, ein Helix-Schleife-Helix-Protein. CLOCK bindet an ein zweites Protein, an das ständig vorhandene konstitutiv (ständig) exprimierte dBMAL1 (codiert vom dbmal1-Gen). Diese Bindung (= Dimerisierung) ermöglicht beiden Partnern den Eintritt in den Zellkern. Gegen Abend sind die Konzentrationen dieses ungleichen Paares (CLOCK verbunden mit dBMALI) hoch genug, um das period- und timeless-Gen, sowie die clock-controlled-Gene zu aktivieren. Diese Aktivierung erfolgt durch Bindung an die DNA und die damit verbundene Aktivierung besagter Gene. Gleichzeitig hemmt der CLOCK/dBMAL1-Komplex seine eigene Herstellung durch Abschaltung des clk-Gens, welches ja für das CLOCK Protein kodiert.
Nach der Aktivierung von period und timeless vergehen einige Stunden, bis die ersten PERIOD- und TIMELESS-Proteine hergestellt sind. Diese sammeln sich an und schalten dann ihre eigene Herstellung ab, indem sie an den CLOCK/dBMAL1-Komplex binden und es damit hemmen. Die Hemmung des Komplexes beseitigt zugleich die Hemmung des clk-Gens, so daß dieses erneut hergestellt wird und ein neuer Zyklus beginnen kann (HARDIN 1999).
Zur Feinabstimmung der Uhr dient folgender Vorgang: Ein Teil der PERIOD-Proteine wird chemisch verändert, (phosphoryliert) und so zum Abbau bestimmt. Die Phosphorylierung erfolgt durch das Enzym Kaseinkinase Ie, die vom double time (dbt)-Gen codiert wird (YOUNG 2000). Dbt war das erste Gen der inneren Uhr von Drosophila das vor 15 Jahren entdeckt wurde. Die Abstimmung der Uhr auf den tatsächlichen Tag-Nacht-Zyklus erfolgt durch das Protein Cryptochrom (CRY), das konstitutiv exprimiert wird und lichtsensitiv ist: in der Anwesenheit von blauem Licht der Wellenlänge von ca. 400-440 Nanometer hemmt es den PER/TIM-Komplex. Diese Synchronisation ist für jede innere Uhr notwendig, die als Hauptfunktion hat, dem Organismus die Vorwegnahme des Tag-Nacht-Zyklus überhaupt zu ermöglichen. Das Licht kann, da der Kopf der Fliege klein ist, direkt die Zellen im Drosophila-Gehirn erreichen, in denen die Uhr eingebaut ist.
Die Ausgabeelemente der Uhr sind die sogenannten clock-controlled-Gene, die in Phase mit der Uhrkomponente PER/TIM schwingen. Sie geben „die aktuelle innere Uhrzeit“ in den Körper weiter und beeinflussen die tagesperiodische Hormonsekretion oder Proteinsynthese. Eines dieser clock-controlled-Gene ist zum Beispiel auch der „Pigment dispersing factor“, ein Hormon, das bei manchen Krebstieren einen täglichen Rhythmus von Farbänderungen vermittelt (HARDIN 1999, CERIANI 1999).
Zusammenfassend, in Drosophila existiert ein zentraler Oszillator, der empfindlich für Licht und andere Umweltreize ist. Diese „Zentraluhr“ synchronisiert die zahlreiche peripheren Uhren, die in vielen Geweben, wenn nicht in allen Körperzellen existieren.
|

|
Wie bei allen Säugern ist in Mäusen die zentrale interne Uhr in einer Gehirnregion lokalisiert, die sich Nucleus suprachiasmaticus nennt. Er ist verantwortlich für alle automatisch regulierten Funktionen der Aufrechterhaltung des inneren physiologischen Gleichgewichts. Ihre Funktion wurde in den letzten Jahren aufgeklärt (GRIFFIN 1999, BARINAGA 2000, SHEARMAN 2000).
Zu Beginn eines Zyklus (am Morgen) steht die Herstellung des mBmal1-Genes (Abb. 2). Das Protein BMAL1 verbindet sich dann mit CLOCK, das ständig hergestellt wird. Der Komplex BMAL1/CLOCK gelangt in den Zellkern und aktiviert drei period-Gene mPer1, mPer2, mPer3, zwei cryptochrom-Gene mCry1 und mCry2 und die clock-controlled-Gene (ccg).
| |
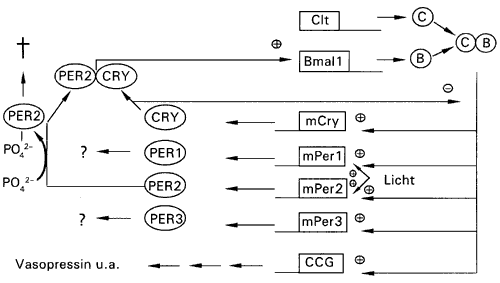 |
| Abb. 2: Die Maua-Uhr. Näheres im Text. | |
Die cryptochrom-Gene hemmen den Komplex von BMAL1/CLOCK, was zum Abschalten der Expression der per’s, cry’s und der ccg’s führt.
PER2 (und wohl auch PER1) verbindet sich mit einem Cryptochrom. Dieser Komplex aktiviert mBmal1 mit einer gewissen Verzögerung, wodurch ein neuer Zyklus gestartet wird. Der Komplex zerfällt mit einer bestimmten Halbwertszeit, so daß das BMAL1 nicht weiter hergestellt wird.
Das Gen tau kodiert für die Kaseinkinase Ie, die PER2 wiederum chemisch verändert (phosphoryliert). Das phosphorylierte PER2 wird abgebaut, ehe es sich mit CLOCK assoziieren kann. Dieser Vorgang dient wieder der Feineinstellung der Periodenlänge (LOWREY 2000).
Die Synchronisation mit dem Tag-Nacht-Zyklus geschieht durch lichtsensitive Zellen in der Netzhaut, die ein Signal zu den Zellen des Nucleus suprachiasmaticus senden. (Dieser erhält kein direktes Licht, da er tief verborgen im Kopf liegt.) Das Signal ist wahrscheinlich ein Botenstoff, der von den Zellen in der Netzhaut produziert wird (Melatonin). Licht bewirkt somit indirekt eine Herstellung von PER1 und PER2. Licht, das früh in der Dunkelphase auftritt, wird folglich eine Phasenverzögerung bewirken, da hohe Konzentrationen von PER1 und PER2 eher erreicht werden.
Die Ausgabelemente der Uhr sind die clock-controlled-Gene, die in Phase mit per und cry hergestellt werden und Effekte im übrigen Körper vermitteln. Einer der Botenstoffe, die diese Effekte übertragen, ist das Protein Vasopressin. Periphere Gewebe haben zum Teil eigene Uhren, die über die clock-controlled-Gene mit der zentralen Uhr synchronisiert werden. In der Ratte beispielsweise wurden Uhren in Leber, Lunge und Muskelgewebe gefunden. (OKAMURA 1999, YAMAZAKI 2000, STOKKAN 2001).
Gemeinsamkeiten. Beide Uhren haben den gleichen grundsätzlichen Aufbau: zwei schwingende Proteinschleifen, die jeweils wechselseitig ihre eigene Herstellung hemmen, sowie ein Ausgabeelement, das gleichzeitig mit einer der beiden Proteinschleifen schwingt. In beiden Organismen, Fruchtfliege wie Maus, kann Licht eine Verstellung der Uhr erzeugen und in beiden sichert ein Enzym, die Kaseinkinase Ie, die Feineinstellung der Periodenlänge (YOUNG 2000). Da dies das einzige Enzym innerhalb der Uhr ist, also ein Protein mit katalytischen Eigenschaften, erscheint es als ein vielversprechendes Ziel für therapeutische Eingriffe, z.B. zur Therapie des Jet-lag-Syndroms nach Interkontinentalflügen.
Unterschiede. Die Synchronisierung mit dem Tageslicht wird auf zwei verschiedene Weisen erreicht: Bei Drosophila durch direkte Interaktion von Licht mit der Uhr mittels eines lichtempfindlichen Proteins, in der Maus über einen längeren Weg: Zellen in der Netzhaut senden ein Signal – wahrscheinlich das Hormon Melanotonin – an die zentrale Uhr. Das Drosophila-Gehirn ist viel kleiner als das der Maus, sodaß genügend Licht hindurchtreten kann, während bei der Maus eine kompliziertere Konstruktion funktionell notwendig ist.
Grundsätzlicher ist der Unterschied in der Funktion der CRY-Proteine: in Drosophila beeinflussen sie die schwingenden Schleifen der Uhr, in der Maus dagegen sind sie essentieller Teil einer dieser Schleifen. Ihre Funktion unterscheidet sich weiterhin dahingehend, daß bei Drosophila CRY die Expression von per stimuliert, während in Mäusen CRY’s die Expression von per, ccg und cry selber hemmen.
In der Maus gibt es wahrscheinlich kein TIMELESS-Protein.
|

|
Aus evolutionstheoretischer Sicht wird der letzte gemeinsame Vorfahr von Insekten und Säugetieren vor mindestens 600 Millionen Jahren angenommen. In dieser Sicht ist es sehr überraschend, daß die Uhren zugleich so ähnlich in zentralen Komponenten und doch so verschieden in einigen wichtigen Bauteilen sind. Besonders die Funktionsänderung der CRY’s dürfte phylogenetisch, also im Sinne eine Abstammungslehre, nicht einfach zu erklären sein.
Der Vergleich der Uhren legt eine Interpretation im Sinne eines Baukastensystems nahe: Ein gegebener Satz von „Bauteilen“ ist in verschiedenen Zusammensetzungen zusammengefügt, so daß Lebewesen unterschiedlichster Form und Ausstattung doch gleiche oder ähnliche Bauteile besitzen können. Lebewesen würden sich so zugleich ähneln und unterscheiden. Wie ein solches Baukastensystem evolutionär entstehen konnte, ist unklar (siehe dazu den Beitrag von Klaus NEUHAUS in dieser Ausgabe).
|

Literatur
- BARINAGA M (1999)
- CRY's clock role differs in mice, flies, Science 285, 506-507.
- BARINAGA M (2000)
- Two feedback loops run mammalian clock, Science 288, 943-944.
- BILLIARD M (1998)
- Le sommeil normal et pathologique, Troubles du sommeil et de l'éveil, 2e édition. Paris - Milan - Barcelone.
- CERIANI MF, DARLINGTON TK et al. (1999)
- Light-dependent sequestration of TIMELESS by CRYPTOCHROME, Science 285, 553-556.
- DELAUNAY F, THISSE C et al. (2000)
- An inherited functional circadian clock in zebrafish embryos, Sciene 289, 297-300.
- GRIFFIN EA JR., STAKNIS D & WEITZ C (1999)
- Light-independent role of CRY1 and CRY2 in the mammalian circadian clock, Science 286, 768-771.
- HARDIN PE & GLOSSOP NRJ (1999)
- The CRY's of flies and mice, Science 286, 2460-2461.
- Lee K, Loros J & Dunlap JC (2000)
- Interconnected feedback loops in the Neurospora circadian system, Science 289, 107-110.
- LOWREY PL, KAZUHIRO S et al. (2000)
- Positional syntenic cloning and functional characterization of the mammalian circadian mutation tau, Science 288, 483-491.
- OKAMURA H, MIYAKE S et al. (1999)
- Photic induction of mPer1 and mPer2 in Cry-deficient mice lacking a biological clock, Science 286, 2351-2534.
- PARK DH, SOMERS DE et al. (1999)
- Control of circadian rhythms and photoperiodic flowering by the Arabidopsis GIGANTEA gene, Science 285, 1579-1582.
- SCHMITZ O, KATAYAMA M et al. (2000)
- CikA, a bacteriophytochrome that resets the cyanobacterial circadian clock, Science 289, 765-768.
- SHAW PJ, CIRELLI C et al (2000)
- Correlates of sleep and waking in Drosophila melanogaster, Science 287, 1834-1837.
- SHEARMAN L P, SRIRAM S et al. (2000)
- Interacting molecular loops in the mammalian circadian clock, Science 288, 1013- 1019.
- STOKKAN KA, YAMAZAKI S et al. (2001)
- Entrainment of the circadian clock in the liver by feeding, Science 291, 490-493.
- STRAYER C, OYAMA T et al. (2000)
- Cloning of the Arabidopsis clock gene TOC1, an autoregulatory response regulator homolog, Science 289, 768-771.
- YAMAZAKI S, NUMANO R et al. (2000)
- Resetting central and peripheral circadian oscillators in transgenic rats, Science 288, 682-685.
- YOUNG MW (2000)
- Marking time for a kingdom, Science 288, 451- 453.
|
|  |
