 |
Das „Phosphat-Problem“ in der präbiotischen Chemie
von Boris Schmidtgall
Studium Integrale Journal
25. Jahrgang / Heft 2 - Oktober 2018
Seite 108 - 112
|
 |
Zusammenfassung: Phosphate sind in biochemischen Systemen lebender Zellen allgegenwärtig. Aufgrund ihrer Reaktionsträgheit scheinen Phosphate allerdings für eine Verwendung im Stoffwechsel ungeeignet zu sein. Zudem sind Phosphate unter geologischen Bedingungen kaum verfügbar. Folglich stellt sich im Rahmen der Abiogeneseforschung* die Frage, wie Phosphate erstmals in biochemische Systeme integriert werden konnten. Ein neuer Vorschlag zur Lösung des „Phosphat-Problems“ erweist sich als unrealistisch und das eigentliche, grundsätzliche Problem bleibt erneut unerwähnt.
|
 |
|
Phosphatgruppen sind unverzichtbar in bekannten biochemischen Systemen
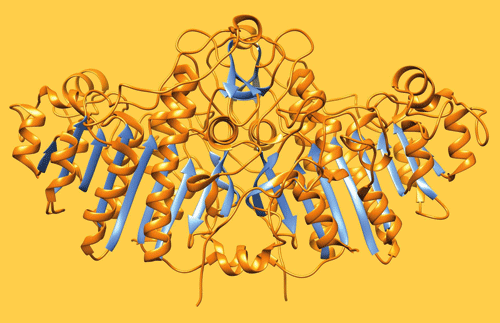 |
| Abb. 1: Bändermodell der alkalischen Phosphatase aus E.coli. |
|
Nicht selten wird das Phänomen Leben mit komplexer Technik verglichen, denn in beiden Fällen liegen ein modularer Aufbau und eine umfangreiche Vernetzung der Module vor. Für letzteres sind kompatible, und damit einhergehend auch einheitliche Anschlüsse unabdingbar. So wäre ein Computernetzwerk ohne einheitliche Anschlüsse nicht funktionsfähig. Ein auffälliges Beispiel für ein einheitliches molekulares Merkmal der zellulären Biochemie sind Phosphateinheiten (Abb. 1).
Phosphate sind in allen physiologischen Vorgängen unverzichtbar. Als Rückgrat der genetischen Moleküle DNA und RNA stellen Phosphate ein essenzielles konstitutives Element dieser biologischen Makromoleküle dar. Das Anbringen und Entfernen von Phosphorylgruppen1* an einer Vielzahl von Biomolekülen (z. B. Lipide, Zucker, Proteine) durch bestimmte Enzyme (Kinasen bzw. Phosphatasen) ist ein wesentliches Grundprinzip der Steuerung physiologischer Vorgänge (Abb. 2).
Darüber hinaus erfolgt die Umwandlung und Übertragung von Energie in Organismen mittels der „Energiewährung“ ATP (Adenosintriphosphat) durch Aufbau bzw. Spaltung der Triphosphateinheit. Es ist daher kaum übertrieben, wenn Westheimer (1987) in der renommierten Wissenschaftszeitschrift Science schreibt: „Es ist eine Gegebenheit, dass Phosphate in der Biochemie ubiquitär sind, aber was tun sie eigentlich? Die Antwort ist, dass sie fast alles tun können.“ Das Erstaunen des Autors rührt daher, dass Phosphate aus chemischer Perspektive für diese Aufgabe denkbar ungeeignet erscheinen. Phosphate sind überaus reaktionsträge, d. h. sie sind – zumindest mit Hilfe organisch-chemischer Methoden – schwer in andere organische Moleküle einzuführen oder daraus zu entfernen. Organische Moleküle, die Phosphateinheiten enthalten, werden vereinfachend als „Organophosphate“ bezeichnet. Bei annähernd neutralem pH-Wert tragen Organophosphate zwei negative Ladungen (pKs2 = 7,2), sodass sie für andere Lösungsmittel als Wasser kaum geeignet sind. Aufgrund ihrer chemischen Eigenschaften werden Organophosphate in Laboratorien der organischen Chemie sehr selten verwendet, obwohl sie in der Biochemie des Lebens allgegenwärtig sind. Eine Ausnahme stellt die chemische Synthese von Nukleinsäuren (in der Laborchemie) dar. Hier werden allerdings recht labile Reagenzien, eine komplexe Synthesestrategie und von Wasser und Sauerstoff befreite, hochreine Lösungsmittel verwendet (Reese 2005).
|
Abiogeneseforschung: Der Begriff „Abiogenese“ bezeichnet die erstmalige Entstehung von Organismen aus unbelebter Materie (sog. Urzeugung), also nicht durch Fortpflanzung. Die Abiogeneseforschung ist die Erforschung chemischer Vorgänge, die von einfachen Molekülen zu den Bausteinen des Lebens (Nukleinsäuren, Proteine, Lipide etc.) geführt haben könnten. Kondensations-Reagenzien: Chemische Verbindungen, die das freigesetzte Wasser bestimmter Reaktionen binden (z. B. bei Veresterungen oder Bildungen von Peptidbindungen) und so die Reaktion in Richtung der Produkte verschieben (auch bei Phosphorylierungen, die zu den Veresterungen zählen). Oligomer: Ein Kettenmolekül aus wenigen Bausteinen, d. h. dass es aus ca. 3-30 strukturell einheitlichen Kettengliedern besteht. Phosphorylgruppe: PO32--Einheit, die durch Kinasen von ATP auf Biomoleküle übertragen wird und von Phosphatasen wiederum entfernt werden kann. primitiv: wenig komplex. Damit sind im Kontext des Artikels hypothetische, einfachere Vorläufer heutiger Organismen gemeint. reduktive Bedingungen: Bedingungen, unter denen einem Molekül Elektronen zugeführt werden. systemisch: das ganze betrachtete System betreffend. Vesikel: kleine Bläschen, die von einer Doppelmembran aus Lipiden umgeben sind.
|
|
|
Wie wurden Phosphate erstmals in biochemische Systeme integriert?
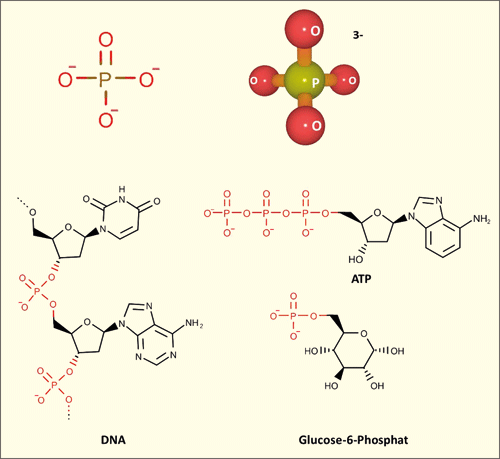 |
| Abb. 2: Oben: Strukturformel der Phosphateinheit (links) und ihre räumliche Darstellung (rechts). Unten: Strukturformeln einiger biologisch relevanter Moleküle mit Phosphatgruppen. |
|
Die angeführten Tatsachen führen direkt zu der Frage, die auch Westheimer (1987) schon unter naturalistischer Prämisse zu beantworten suchte: Wie ist es dazu gekommen, dass ausgerechnet die aus chemischer Perspektive ungeeigneten Phosphate zu einer Schlüsseleinheit in der Biochemie geworden sind?2
 |
| In Laboratorien der organischen Chemie werden Organophosphate sehr selten verwendet, obwohl sie in der Biochemie des Lebens ubiquitär sind. |
 |
|
Zu erklären wäre demnach, welche chemischen Prozesse dazu geführt haben könnten, dass hypothetische primitive biochemische Systeme in der Anfangszeit der mutmaßlichen Abiogenese Phosphateinheiten systemisch* integriert haben konnten. Westheimer legt zwar durchaus überzeugend dar, wozu Phosphate in biologischen Systemen nötig sind: Zum einen müssen Biomoleküle geladen sein, da neutrale Moleküle dazu neigen, die Membran zu passieren und die Zelle zu verlassen. Zum anderen sind Phosphate gegenüber der Spaltung durch Wasser ausgesprochen widerstandsfähig, sodass sie dem biologischen System die für Langlebigkeit unverzichtbare Stabilität verleihen. Die Frage nach einem konkreten chemischen Vorgang zur erstmaligen Einführung der Phosphate in biochemische Systeme ließ Westheimer allerdings unbeantwortet, indem er vage auf „historische Gründe“, also letztlich auf irgendwelche zufälligen Ereignisse, als Ursache verwies.
Eine wesentliche Hürde für naturalistische Erklärungen der Westheimer‘schen Fragestellung stellt die bereits erwähnte Reaktionsträgheit der Phosphatgruppen dar. Zudem ist Phosphat unter geologischen Bedingungen kaum verfügbar, da es sehr häufig in praktisch unlöslichen Kalzium-Mineralien wie Hydroxylapatit3 gebunden vorliegt. Aus diesem Grund haben viele Forschungsgruppen schon vor fast fünfzig Jahren chemische Versuche unter verschiedenen Bedingungen und dem Einsatz von sog. Kondensations-Reagenzien* durchgeführt, um die Einführung von Phosphatgruppen in die molekularen Bausteine der ersten Organismen zu plausibilisieren. Lohrmann & Orgel (1973) schlugen vor, dass zuerst Adenosin in Gegenwart von anorganischen Phosphaten, Mg2+ und Harnstoff zunächst zu Adenosintriphosphat (ATP), der „Energiewährung“ der Organismen, umgesetzt wurde, sodass die Phosphorylierung anderer Biomoleküle ermöglicht wurde – ein Ansatz, der aufgrund des Voraussetzens von Adenosin nicht plausibel ist. Die Verfügbarkeit von Adenosin unter präbiotischen Bedingungen ist ein eigenständiges, ungelöstes Problem.
 |
| Phosphat ist unter geologischen Bedingungen kaum verfügbar, da es in unlöslichen Mineralien vorliegt. |
 |
|
Weitere Versuche wie die Verwendung von Cyanaten zur Aktivierung von Phosphaten (Yamagata 1999) waren aufgrund der hochspezifischen Bedingungen und nur sehr geringen Ausbeuten auch nicht überzeugend. Daher kam Eschenmoser (1999) etwa 30 Jahre nach den ersten Experimenten auf diesem Gebiet zu folgender Einschätzung: „[…] Während die groben Muster des Zusammenbaus der RNA-Struktur aus solchen Bausteinen klar zu sein scheinen, fehlt es an überzeugenden experimentellen Beweisen, dass solche Prozesse tatsächlich unter präbiotischen Bedingungen auftreten können. Dies trifft insbesondere auf entscheidende Schritte wie die Bildung von Nukleotiden oder die Aktivierung von Phosphateinheiten zu.“4
Auch neuere hypothetische Ideen, wie etwa die von Benner et al. (2012) vorgeschlagene Phosphitylierung unter reduktiven* Bedingungen mit nachfolgender Oxidation zu Phosphaten, helfen nicht weiter, solange keine überzeugenden experimentellen Belege für die Plausibilität eines solchen Vorgangs vorgestellt werden. Eine aktuelle Übersicht zahlreicher experimenteller Bedingungen (Gull 2014) zeigt, dass die Suche nach einer realistischen Variante der präbiotischen Phosphorylierung bisher zu keinem zufriedenstellenden Resultat geführt hat.
|
Dass das Problem der äußerst geringen Verfügbarkeit von Phosphaten unter präbiotischen Bedingungen Wissenschaftlern durchaus bewusst ist, zeigt auch ein Zitat von Harrer (2018) aus einem kürzlich in Chemie in unserer Zeit erschienenen Artikel: „Eine sehr wichtige Komponente für die lebende Zelle ist das Phosphat. Das Ion stammte wohl einfach aus dem umliegenden Gestein und konnte durch die Chemikalienmischung herausgelöst werden; der genaue Mechanismus dafür ist jedoch unbekannt.“5 Hier wird einmal mehr deutlich, wie für die Möglichkeit einer Urzeugung argumentiert wird. Es wird schlicht behauptet, dass für das eigentliche Problem eine einfache Lösung zur Verfügung stünde. Anschließend wird auf unbekannte Mechanismen oder irgendwelche undefinierten Chemikalienmischungen verwiesen. Auf diese Weise werden Probleme, die ausdrücklich gegen die Möglichkeit der Urzeugung sprechen, umgangen oder verharmlost.
|
|
|
Diaminophosphat (DAP) – die Lösung des Phosphat-Problems?
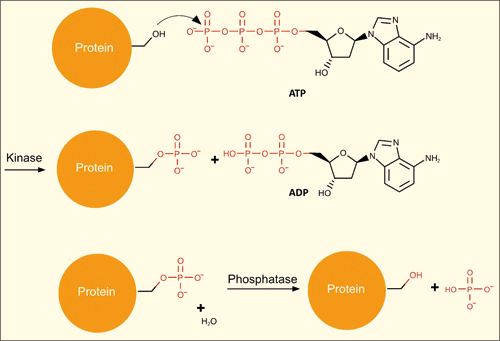 |
| Abb. 1: Schematische Darstellung der Phosphorylgruppen-Übertragung in Organismen. Phosphorylgruppen werden durch Kinasen in Biomoleküle unter Verbrauch von ATP eingeführt. Phosphatasen spalten Phosphorylgruppen von Biomolekülen ab. |
|
Vor dem Hintergrund der bisherigen Resultate heißt es in einer kürzlich erschienenen Publikation (Gibard et al. 2018): „Präbiotische Phosphorylierungen (prä)biologischer Substrate in wässrigem Milieu stellen hinsichtlich der Frage nach der Lebensentstehung einen kritischen Schritt dar. Frühere Untersuchungen hatten einen beschränkten Erfolg oder benötigten spezifische Bedingungen, welche mit der nachfolgenden Entstehung entsprechender Oligomere* oder übergeordneter Strukturen inkompatibel sind.“ Daher versuchten die Autoren um Gibard ihrerseits ein plausibles Model für die präbiotische Phosphorylierung auf der Grundlage experimenteller Daten aufzustellen. Dabei führen die Autoren als Verbesserung gegenüber früheren Versuchen an, dass ein chemischer Vorgang gefunden worden sei, der in wässriger Lösung abläuft und ohne Kondensations-Reagenzien auskommt. Außerdem, so die Autoren, ließen sich verschiedene biologisch relevante Moleküle (Fettsäuren, Nukleotide, Aminosäuren) unter den gleichen Bedingungen phosphorylieren (Abb. 3).
Im Mittelpunkt der Argumentation steht die chemische Verbindung „Diaminophosphat“ (DAP) – ein Molekül, das sich vom Phosphat dadurch unterscheidet, dass zwei Sauerstoffatome durch jeweils eine Aminogruppe ersetzt sind (s. Abb. 3). Die Reaktionen von DAP mit verschiedenen Biomolekülen wurden bei neutralem oder leicht saurem pH-Wert (5,5) durchgeführt und wahlweise Imidazol, Zinkchlorid oder Magnesiumchlorid dazugegeben. In einigen Fällen wurden die Verbindungen in trockener Form vermischt und nur wenige Tropfen Wasser zugesetzt, sodass eine Paste entstand („paste conditions“). Die Autoren konnten nachweisen, dass unter den gewählten Reaktionsbedingungen auch Polymerisationsreaktionen stattfinden, sodass kurze Ketten aus bis zu vier Nukleotiden bzw. acht Aminosäuren gebildet werden konnten. Des Weiteren konnte im Rahmen der Studie gezeigt werden, dass eine Mischung aus Glycerin, einer Fettsäure (Nonansäure), Imidazol, DAP und einigen Tropfen Wasser zur Bildung eines Cyclophospholipids führte, welches bei Hinzugabe einer wässrigen, leicht alkalischen Lösung (pH ~8,5) zur Bildung von Vesikel*-artigen Strukturen führte.
|
|
|
|
Phosphorylierung mit DAP: ausgefeilte Experimentierkunst, aber keine präbiotische Chemie
Auch wenn die Ergebnisse von Gibard et al. zunächst durchaus beeindruckend erscheinen, wird bei näherer Betrachtung der Publikation einschließlich der im Experimentalteil geschilderten Bedingungen deutlich, dass auch hier keine Lösung des präbiotischen „Phosphat-Problems“ präsentiert wurde. Schon die Bedingungen, unter denen das DAP erhalten werden kann, sind keineswegs realistisch für ein präbiotisches Szenario (Abb. 4).
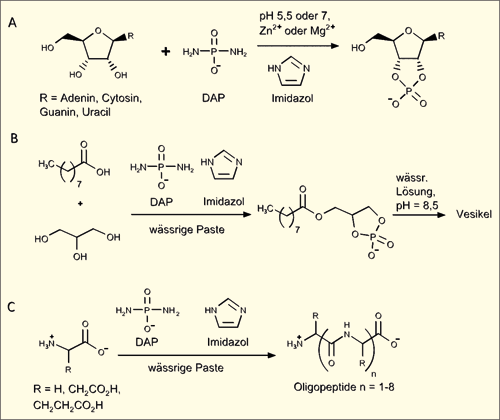 |
| Abb. 4: Reaktionen von DAP mit A.) Nukleosiden, B.) Carbonsäure und Glycerin, C.) Aminosäuren. |
|
Das geben die Autoren fairerweise selbst zu – wenn auch sehr vorsichtig: „Obwohl DAP bereits als plausibles präbiotisches Reagenz verwendet wurde, ist es aus dem präbiotisch verfügbaren Trimetaphosphat durch Reaktion mit Ammoniak bei sehr hohem pH-Wert hergestellt worden.“ Die Annahme, dass Trimetaphosphat unter präbiotischen Bedingungen entstehen kann, ist nicht abwegig. Dagegen dürfte das Vorkommen von konzentriertem Ammoniak (hoher pH-Wert) unter geologischen Bedingungen aufgrund seiner hohen Reaktivität und Flüchtigkeit praktisch ausgeschlossen sein. Auch das Mineral Schreibersit, das von Gibard et al. als mögliche natürliche DAP-Quelle vorgeschlagen wurde, scheidet aus, da es sich um ein seltenes, hauptsächlich auf Meteoriten vorkommendes Mineral handelt (Leitmeier 1926). Es handelt sich eben nicht um ein „Allerweltsgestein“, wie Osterkamp (2017) in einem Online-Beitrag von Spektrum fälschlich unterstellte. Aber selbst wenn DAP unter natürlichen Bedingungen entstanden sein sollte, ist es sehr unwahrscheinlich, dass es im wässrigen Milieu dauerhaft verfügbar gewesen sein kann, da Phosphor-Stickstoff-Bindungen in Wasser generell labil sind, umso mehr in Gegenwart von geologisch häufig vorkommenden Zinkionen (Zn2+).
Ein weiteres gravierendes Problem hängt mit den typischen Synthesebedingungen zusammen, die in der Publikation geschildert werden. Da das DAP selbst ausgesprochen basisch ist, steigt bei dessen Zugabe zum Reaktionsgemisch der pH-Wert erheblich. Brauchbare Ergebnisse konnten aber nur im pH-Bereich zwischen 5,5 und 8 erhalten werden. Daher war es stets erforderlich, zu Beginn der Reaktion den pH-Wert mittels relativ hoch konzentrierter Salzsäure nach unten zu korrigieren – ein Eingriff, der unter präbiotischen Bedingungen nicht zu erwarten ist.
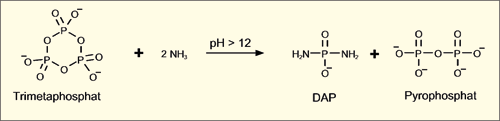 |
| Abb. 5: Reaktion zur Synthese von DAP aus Trimetaphosphat und Ammoniak bei hohem pH-Wert. |
|
Ein weiteres Problem, das gar nicht diskutiert worden ist, stellt die fortwährende, dosierte Zugabe von DAP während der gesamten Reaktionszeit dar. Dies war erforderlich, da sich das labile DAP in der wässrigen Lösung allmählich durch Reaktion mit Wasser zersetzt (Hydrolyse). Durch Zugabe von Zinkchlorid wurde diese Zersetzung wesentlich beschleunigt. In den Protokollen der Experimente heißt es oft: „Zusätzliches DAP wurde in Abhängigkeit des Reaktionsverlaufs und des DAP-Verbrauchs, der anhand von NMR-Spektroskopie überprüft wurde, hinzugefügt.“ Der Reaktionsverlauf wurde also stets beobachtet und die Zusammensetzung im Sinne eines guten Resultats verändert. Das allein ist schon alles andere als präbiotisch. Erschwerend kommt hinzu, dass bei fortgesetzter Zugabe von DAP auch wiederholt konzentrierte Salzsäure dazugegeben werden musste, da sonst der pH-Wert gestiegen und die Reaktion zum Erliegen gekommen wäre. Die Autoren geben an, dass dieses Problem durch Zusetzen von Imidazol abgemildert wurde, da auf diese Weise der pH-Wert im annähernd neutralen Bereich stabilisiert werden konnte. Allerdings ergäbe dies bereits vier Komponenten, die richtig dosiert vorliegen müssen, damit die Reaktion zu dem erhofften Ergebnis führt – unter präbiotischen Bedingungen eine äußerst unwahrscheinliche (im Grunde unmögliche) Konstellation. Eine selbstkritische Bemerkung zu diesen Kunstgriffen in der Publikation von Gibard et al. wäre wünschenswert gewesen.
Ein anderes wichtiges Argument, das die Autoren der Studie für die Plausibilität ihres Ansatzes anführen, ist die angebliche Kompatibilität der Bedingungen mit der spontanen Bildung von biologischen Oligomeren und komplexeren biologischen Strukturen, wie z. B. Vesikeln. Hierzu ist aber zu sagen, dass die erhaltenen Oligomere mit vier Nukleotiden bzw. acht Aminosäuren viel zu kurz waren, als dass sie eine wesentliche funktionelle Rolle hätten gespielt haben können. Die kleinsten bekannten Proteine, die Funktionen ausüben können, bestehen aus ca. 40 Aminosäuren und die Genome der kleinsten Organismen sind sogar mehrere Hunderttausend Nukleotide lang. Auch die Bildung von Vesikeln unter den verwendeten Bedingungen ist kaum von Relevanz, wenn nicht gezeigt werden kann, dass dabei zugleich funktionelle Moleküle eingeschlossen werden und z. B. Reaktionszyklen etabliert werden. Ebenso ist es nicht überzeugend, wenn vermutet wird, dass alle biologischen Moleküle in einem Gefäß unter einheitlichen präbiotischen Bedingungen phosphoryliert werden können, bloß weil die Reaktionen getrennt unter den gleichen Bedingungen erfolgten. Es wäre nicht sehr aufwändig gewesen, einen solchen Versuch durchzuführen, dennoch fehlt er in der besprochenen Arbeit von Gibard et al.
|
|
Das wirkliche Phosphat-Problem ist weitaus größer
Insgesamt wird deutlich, dass es sich bei der Studie von Gibard et al. um ein weiteres Beispiel von Experimentierkunst handelt, die fälschlicherweise als präbiotische Chemie ausgegeben wird. DAP, das ein in wässriger Lösung ein labiles Reagenz ist und dessen mögliche geologische Quelle nicht überzeugend aufgezeigt werden kann, eignet sich nicht als Ausgangsmaterial für eine Simulation chemischer Prozesse, die zur systemischen Ausstattung nahezu aller Biomoleküle mit Phosphateinheiten geführt haben sollen. Für Reaktionen, die überwacht und im Sinne eines brauchbaren Ergebnisses gesteuert werden, ist in keiner Weise die Bezeichnung „präbiotische Chemie“ angebracht.
 |
| Damit ein biochemisches System läuft, braucht es alle drei Komponenten zugleich: phosphorylierte Biomoleküle, Kinasen und Phosphatasen. |
 |
|
Das größte Rätsel jedoch wird von all den hier zitierten Autoren nicht einmal erwähnt: Selbst wenn die molekularen Bausteine unter präbiotischen Bedingungen mit Phosphat-Einheiten versehen werden konnten, stellt sich die Frage, wie sich ein dynamisches System herausbildete, in welchem Phosphorylgruppen ausreichend schnell übertragen werden konnten. In bekannten Organismen werden diese Vorgänge durch zwei Sorten von Enzymen vermittelt. Enzyme mit der Sammelbezeichnung „Kinasen“ übertragen Phosphorylgruppen von ATP auf andere Biomoleküle, während Phosphatasen die Phosphorylgruppen wieder entfernen. Im Lehrbuch „Stryer Biochemie“ (2007) heißt es: „Es ist wichtig festzuhalten, dass Phosphorylierung und Dephosphorylierung nicht einfach die Umkehr voneinander sind. Unter physiologischen Bedingungen sind beide Reaktionen grundsätzlich irreversibel. Darüber hinaus finden beide Reaktionen ohne Enzyme so gut wie nicht statt.“
Wie aber kann ein effektives Übertragungssystem angesichts der Reaktionsträgheit der Phosphate unter präbiotischen Bedingungen beschaffen gewesen sein, wo komplexe Enzyme fehlten? Denn ein biochemisches System ohne funktionierende Phosphorylgruppen-Übertragung ist vergleichbar einem Computernetzwerk ohne passende Kabelanschlüsse – es läuft nicht. Damit also ein biochemisches System läuft, braucht es alle drei Komponenten zugleich: eine Reihe phosphorylierter Biomoleküle und zwei Sorten von Enzymen: Kinasen und Phosphatasen (Abb. 2). Eine schrittweise Entstehung eines solchen Systems im Sinne eines naturalistischen Modells erscheint abwegig, da jede Komponente für sich alleine in keinem funktionellen Zusammenhang steht. Vielmehr erscheint es als ein ausgeklügeltes und erstaunlich stabiles System, das sinnvoll als eine nichtreduzierbar komplexe Einheit bezeichnet werden kann, die auf der Basis unserer Kenntnisse über chemische Reaktionen nur als intelligent angelegte Entität verstehbar ist.
|
Anmerkungen
1 Das Anbringen einer Phosphorylgruppe (PO32-) resultiert üblicherweise in der Bildung einer Phosphateinheit (Abb. 2).
2 Westheimer selbst formulierte die Frage: „Warum hat die Natur Phosphate gewählt?“ und versuchte Antworten sowohl auf das „Warum“ als auch das „Wie“ zu geben.
3 Aus diesem Mineral bestehen die Zähne von Menschen. Wenn es auch nur geringfügig wasserlöslich wäre, hätten wir ein schwerwiegendes Problem.
4,5 Hervorhebung B. S.
|
|
|
Literatur
- Benner SA et al. (2012)
- Asphalt, water, and the prebiotic synthesis of ribose, ribonucleosides, and RNA. Acc. Chem. Res. 45, 2025-2034.
- Berg JM, Tymozcko JL & Stryer L (2007)
- Stryer Biochemie. 6. Aufl. Elsevier Verlag, S. 317.
- Eschenmoser A (1999)
- Chemical etiology of nucleic acid Structure. Science 284, 2118-2123.
- Gibard C et al. (2018)
- Phosphorylation, oligomerization and self-assembly in water under potential prebiotic conditions. Nat. Chem. 10, 212-217.
- Gull M (2014)
- Prebiotic phosphorylation reactions on the early earth. Challenges 5, 193-212.
- Joyce et al. (1984)
- Non-enzymatic, template-directed synthesis on RNA random copolymers, J. Mol. Biol. 176, 279-306.
- Leitmeier H (1926)
- Phosphornickeleisen. In: Handbuch der Mineralchemie. Band III, zweite Hälfte. Springer, Berlin, Heidelberg, S. 810-825.
- Lohrmann R & Orgel LE (1973)
- Prebiotic activation processes. Nature 244, 418-420.
- Osterkamp J (2017)
- Kickstarter des Lebens in der Ursuppe, https://www.spektrum.de/news/kickstarter-des-lebens-in-der-ursuppe/1516153.
- Reese CB (2005)
- Oligo- and poly-nucleotides: 50 years of chemical synthesis, Org. Biomol. Chem. 3, 3851-3868.
- Westheimer FH (1987)
- Why nature chose phosphates, Nature 235, 1173-1178.
- Yamagata Y (1999)
- Prebiotic formation of ADP and ATP from AMP, calcium phosphates and cyanate in aqueous solution. Orig. Life Biosphere 29, 511-520.
|
|
|  |
