 |
Die „Lebenden Steine“ und ihre Verwandten (Aizoaceae: Ruschieae) von Herfried Kutzelnigg
Studium Integrale Journal
16. Jahrgang / Heft 2 - November 2009
Seite 100 - 104
|
 |
Zusammenfassung: Die „Lebenden Steine“ aus der Familie der Mittagsblumengewächse bilden zusammen mit ihren Verwandten eine an extreme Trockenheit angepasste Pflanzengruppe, die vor allem im Süden Afrikas beheimatet ist. Mit über 1500 Arten sind die Pflanzen einerseits sehr vielgestaltig, andererseits sind sie wegen ihrer morphologischen und molekularbiologischen Gemeinsamkeiten als einheitlich ausgewiesen. Da man davon ausgeht, dass der zugehörige Lebensraum erst vor ca. 5 Millionen Jahren herkömmlicher Zeitrechnung entstanden ist, wird diese Pflanzengruppe in der Literatur als Beispiel für eine Radiation bezeichnet, die sowohl vom Umfang als auch von der Geschwindigkeit her unübertroffen ist. Zwischen den Gattungen gibt es zahlreiche Kreuzungsverbindungen, so dass die Gruppe insgesamt als Grundtyp aufgefasst werden kann.
|  |
|
Einleitung
 |
| Abb. 1: Typischer Vertreter der „Lebenden Steine“ (Gattung Lithops). Aus dem steinigen Boden ragen nur die Spitzen der Blattpaare heraus. Foto: A. Kutzelnigg. |
|
Zu den besonders eindrucksvollen Naturerscheinungen gehören die unter dem Namen „Lebende Steine“ bekannt gewordenen Pflanzen. Das sind wasserspeichernde (= sukkulente) Arten, die im Extremfall nur wenig aus dem Boden herausragen und oft so getarnt sind, dass man sie zunächst für Kieselsteine halten könnte (Abb. 1). Sie bestehen zur Hauptsache aus einem Blattpaar und sind an starke Trockenheit und hohe Sonneneinstrahlung angepasst, indem die Photosynthese im Schutz des Erdbodens stattfindet, und das nötige Sonnenlicht wie durch ein Fenster dorthin gelangt (Abb. 2). Wenn die „Steine“ blühen (Abb. 3), zeigen sie die charakteristische Blüte aller Mittagsblumen-gewächse (Aizoaceae), wie man sie auch hierzulande zuweilen in Gärten finden kann. Die dekorativen, in der Sonne meist weit geöffneten Blüten mit ihren sehr zahlreichen schmalen Kronblättern und meist ebenfalls zahlreichen dicht stehenden Staubblättern erinnern etwas an die Körbchen der Korbblütler, es handelt sich aber im Gegensatz zu letzteren um Einzelblüten.
|
|
Die Vielfalt der „Lebenden Steine“ und ihrer Verwandten (Ruschieae)
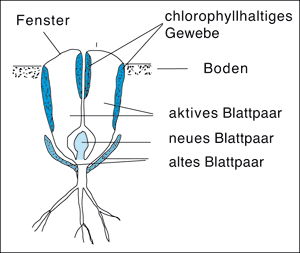 |
| Abb. 2: Längsschnitt durch Lithops als ausgeprägtem Vertreter der „Lebenden Steine“. Die Pflanze besteht zur Hauptsache aus zwei wasserspeichernden Blättern, die fast völlig im Erdboden verborgen sind, wo auch die Photosynthese stattfindet. Das Licht fällt an der Oberseite der Blätter ein, die wie ein Fenster fungiert, und gelangt durch das glasig durchsichtige Blattinnere zu dem randlich gelegenen chlorophyllhaltigen Gewebe. |
 |
| Abb. 3: Ein Verwandter der „Lebenden Steine“ (Gattung Glottiphyllum) im blühenden Zustand. Foto: A. Kutzelnigg. |
|
Die Verwandtschaft der „Lebenden Steine“ ist mit ca. 100 Gattungen und 1563 Arten ausgesprochen vielgestaltig, so dass die oben geschilderten Formen nur ein Extrembeispiel darstellen. Die Vielzahl der Erscheinungsformen hängt mit dem Lebensraum dieser Pflanzengruppe zusammen, der aufgrund seiner kleinflächig wechselnden Bodenstruktur die unterschiedlichsten ökologischen Nischen bereit hält. Dieser Lebensraum ist das so genannte Succulent Karoo, eine Trockenzone mit gemäßigten Temperaturen und winterlichen Regenfällen im Bereich westliches Südafrika/Namibia. Einige Arten wachsen auch in den Nachbargebieten, aber außerhalb davon gibt es nur wenige Vorkommen. Die Vegetation des Succulent Karoo ist mit etwa 5000 Arten besonders vielfältig. Vorherrschend sind Blattsukkulenten, wobei allein 1750 Arten von der Familie der Mittagsblumengewächse gestellt werden, die etwa 90% der Biomasse dieser Region ausmachen.
Die „Lebenden Steine“ und ihre Verwandten sind ausdauernd und sukkulent, und zwar meist blattsukkulent mit dreikantigem oder rundlichem Blattquerschnitt, aber auch Stammsukkulenz mit oder ohne periodischen Laubfall kommt vor. Die paarweise angeordneten Blätter sind oft an ihrer Basis, manchmal sogar fast vollständig verwachsen. Von der Lebensform her überwiegen niedrige Halbsträucher, also ausdauernde Pflanzen, die im unteren Teil etwas verholzen. Man findet aber auch vollständig verholzte, niedrige oder auch größere Sträucher und sogar Lianen und baumartige Formen. Nicht selten werden je nach Jahreszeit unterschiedlich gebaute Blätter ausgebildet (Heterophyllie). Die Blüten sind weiß oder gelb bis rot. Die zugehörigen Farbstoffe sind – wie allgemein in der Familie – nicht die sonst im Pflanzenreich üblichen Anthocyane bzw. Flavonoide, sondern die von der Roten Bete bekannten roten Betalaine und gelben Betaxanthine. Die Nektar absondernden Gewebe (Nektarien) sind schopfig. Die Kronblätter sind umgewandelte Staubblätter. Wie viele andere sukkulente Pflanzen folgen die Arten dem CAM-Weg der Photosynthese. Dabei wird in Anpassung an die Trockenheit des Standorts nachts CO2 aufgenommen, das dann tagsüber der Photosynthese zugeführt wird. Auf diese Weise können am Tage die Spaltöffnungen geschlossen bleiben, wodurch der Wasserverlust der Pflanze stark reduziert wird. Die Früchte sind meist vielsamige Kapseln, die sich gewöhnlich bei Feuchtigkeit öffnen und bei Trockenheit wieder schließen. Diese Anpassung ermöglicht das Keimen der Samen während der kurzen Regenzeiten. Die Chromosomenzahl liegt einheitlich bei x = 9.
Systematisch gesehen stellen die Pflanzen einen als Tribus Ruschieae bezeichneten Teil der Unterfamilie Ruschioideae dar (Abb. 4), die neuerdings in die weit gefasste Familie der Mittagsblumen- oder Eiskrautgewächse (Aizoaceae) eingereiht wird und früher als Teil der Mesembryanthemaceae (kurz „Mesembs“ genannt) aufgefasst wurde. Der Name Eiskraut weist dabei auf ein typisches Familienmerkmal hin, nämlich blasenförmige Zellen in der Epidermis, die in manchen Fällen wie Eiskristalle aussehen. Wie aus Abb. 4 zu ersehen ist, machen die Ruschieae von der Artenzahl her den größten Teil der Familie aus. Die beiden übrigen Triben der Unterfamilie (Apatesieae und Dorotheantheae) unterscheiden sich von den Ruschieae u.a. dadurch, dass ihre Blätter flach und nicht stark sukkulent sind, die Arten einjährig (bis ausdauernd, krautig) sind und die Früchte bei der Reife in Teilfrüchte zerfallen.
|
|
Die Einheitlichkeit der Ruschieae
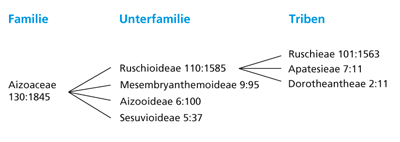 |
| Abb. 4: Systematische Stellung der „Lebenden Steine“ und ihrer Verwandten (Tribus Ruschieae) innerhalb der Familie der Mittagsblumengewächse (Aizoaceae). Die erste Zahl gibt jeweils die Anzahl der Gattungen, die zweite die der Arten an. |
|
Trotz der geschilderten Vielfalt stellen die Ruschieae (im weit gefassten Sinne von z. B. Schwantes 1971) wegen zahlreicher Gemeinsamkeiten eine einheitliche und nach außen gut abgegrenzte Gruppe dar. Historisch interessant ist, dass ihre Vertreter (allerdings unter Einschluss einiger weiterer Arten der Familie) noch bis zum Beginn des 20. Jh. in die damalige Großgattung Mesembryanthemum gestellt wurden, die dann aber aufgelöst wurde. Die Einheitlichkeit der Pflanzengruppe wird durch verschiedene Sachverhalte deutlich:
1. Die Gattungen sind im Hinblick auf morphologische Kriterien so eng miteinander verknüpft, dass es bisher nicht geglückt ist, eine allgemein akzeptierte Untergliederung der Ruschieae aufzustellen. Bei den Einteilungsversuchen standen Merkmale des Fruchtbaus und der Lebensformen im Vordergrund. Schwantes (1971) unterschied 22 Subtriben. Hartmann (1998, 2001) teilte später in 10 Gruppen ein, die sich mit der Einteilung von Schwantes nur zum Teil in Deckung bringen ließen und wegen der Vorläufigkeit der Daten nicht formal als Subtriben beschrieben wurden. Kürzlich schlugen Chesselet et al. (2002) aufgrund des Feinbaus der Nektarien eine Zweiteilung der Gruppe in die Ruschieae sensu stricto mit ringförmig verbundenen Nektarien und eine neu aufgestellte Tribus Delospermeae mit freien Nektarien vor, in der sie 3 der 10 Gruppen von Hartmann zusammenfassen (Bergeranthus-, Delosperma- und Stomatium-Gruppe) (vgl. Abb. 6). Dieser Einteilung wurde aber nicht allgemein gefolgt, vor allem spiegelt sie sich auch nicht in den molekularen Daten wieder (siehe unten). Auch die Abgrenzung der Gattungen gegeneinander ist sehr schwierig. Das ist eine Erscheinung, der man neben der geschilderten Merkmalsvernetzung nicht selten bei Grundtypen bzw. sehr einheitlichen Taxa begegnet.
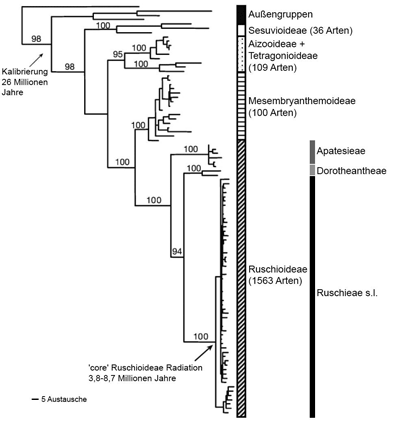 |
| Abb. 5: Molekulares Baumdiagramm (Phylogramm) der Familie der Mittagsblumengewächse (Aizoaceae) aufgrund des Vergleiches von DNA-Sequenzen aus zwei Bereichen der Chloroplasten-DNA. Die horizontale Länge der Äste entspricht der Anzahl der Änderungen in der DNA. Man erkennt deutlich, dass die Vertreter der Ruschieae sensu lato trotz ihrer hohen Artenzahl bezüglich der DNA-Sequenzen fast keine Unterschiede zeigen. Nach Klak et al. 2003, 2004. |
|
2. Durch molekulare Vergleiche von zwei Plastiden-DNA-Sequenzen von Vertretern der Familie Aizoaceae konnte die Einheitlichkeit der Ruschieae besonders eindrucksvoll demonstriert werden (Klak et al. 2003, 2004). Die genetische Variation zwischen den Vertretern der Ruschieae (von den Autoren als ‚core’ Ruschioideae bezeichnet) ist extrem gering (Abb. 5), während die beiden anderen Triben der Ruschioideae (und die übrigen Unterfamilien) deutlich von den Ruschieae unterschieden werden können. Besonders bemerkenswert ist, dass die erst kurz zuvor aufgrund morphologischer Kriterien als Tribus Delospermeae abgegrenzten drei Gruppen durch die molekularen Daten nicht unterstützt werden, weswegen Chesselet et. al. (2004) die Abtrennung der Delospermeae wieder aufgehoben haben.
Allerdings bilden innerhalb der Ruschieae einige wenige Arten eine eigene Gruppe (Abb. 5, ganz unten im Baum). Es handelt sich um alle in die Untersuchung einbezogenen sechs Arten der Gattung Drosanthemum und eine Art aus der Gattung Delosperma, die erst kürzlich aus Drosanthemum ausgegliedert und inzwischen auch wieder eingegliedert wurde. Die Gattung Drosanthemum umfasst ca. 120 Arten und ist morphologisch sehr heterogen. Sie wurde bisher als Teil der Delosperma-Gruppe aufgefasst (die im Baum zum großen Nachbarast gehört) und ist morphologisch zum Teil schwer von anderen Gattungen dieser Gruppe zu trennen. Auffallend ist u.a., dass einige Arten der Gattung am Grunde nicht verwachsene Blätter besitzen, was bei den restlichen Ruschieae nicht vorkommt, und die Blätter meist mit großen, wassergefüllten Blasenzellen bedeckt sind. Auch sind Teile der Gattung arealkundlich etwas von den anderen Gattungen unterschieden. So könnte der Drosanthemum-Ast tatsächlich eine eigene evolutive Linie bilden, wie der Baum in Abb. 5 nahelegt, aber die genetischen Unterschiede zum Rest der Ruschieae sind sehr klein. Gleichwohl nehmen Chesselet et al. (2003) die Befunde zum Anlass, diesen Ast im Tribusrang als Drosanthemeae vom Rest der Ruschieae i. e. S. zu trennen.
3. Landrum (2001) entdeckte bei einigen Familien der Caryophyllales, so u.a. auch bei den Aizoaceae, die Weitbandtracheiden als neuen Typ von Wasserleitungsbahnen. Dieser Typ von Tracheiden ist durch dicke Sekundärwände gekennzeichnet und hat wahrscheinlich die Aufgabe, im Fall von Wasserstress das Kollabieren der Zellen zu verhindern. Soweit bei den 89 untersuchten Gattungen der Aizoaceae solche Tracheiden gefunden wurden, waren sie auf Blätter der Ruschieae beschränkt.
4. Bei einer repräsentativen Stichprobe von 69 Arten der Aizoaceae stellten Thiede et al. (2007) fest, dass alle Vertreter der Ruschieae (inkl. Drosanthemum) sich von den übrigen Untergruppen der Familie durch das Fehlen des Introns im Plastidengen rpoC1 unterscheiden.
So gibt es also insgesamt zahlreiche Beobachtungen, die einerseits die innere Einheitlichkeit der Ruschieae und andererseits ihre klare Abgrenzung nach außen belegen.
|
|
Schnelle Evolution bei den Ruschieae
Wegen ihrer Vielfalt stellen die Lebenden Steine mit ihren Verwandten ein eindrucksvolles Beispiel für eine adaptive Radiation dar, also eine mikroevolutive Auffächerung mit auffälligen Anpassungserscheinungen an sehr unterschiedliche Lebensbedingungen.
Angesichts der mit etwa 2000 Arten hohen Artenzahl der Familie in der ökologischen „Meganische“ Succulent Karoo hatte schon Ihlenfeldt (1994) die Vermutung ausgesprochen, dass deren Evolution besonders schnell stattgefunden habe, ja konkurrenzlos schnell innerhalb der Angiospermen dastünde. Er begründete dies damit, dass der zugehörige vielgestaltige Lebensraum als ökologische Meganische erst vor etwa 5 Millionen Jahren herkömmlicher Zeitrechnung entstanden sei. Klak et al. (2004) greifen in einer eigenen Publikation im Anschluss an ihre oben dargestellten Sequenzanalysen diesen Gedanken wieder auf, beschränken ihn aber jetzt auf die Ruschieae (‚core’ Ruschioideae) und versuchen, ihn aufgrund der Idee der molekularen Uhr zu konkretisieren. Danach soll die Radiation erst vor relativ kurzer Zeit (im Wesentlichen vor 3,8-8,7 Millionen Jahren herkömmlicher Zeitrechnung) stattgefunden haben und in einer Geschwindigkeit erfolgt sein, die bisher aus dem Tier- und Pflanzenreich unbekannt ist.
|
|
Die Ruschieae – ein Grundtyp
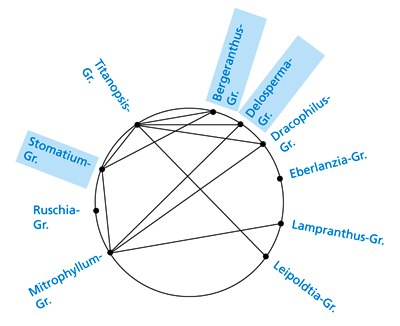 |
| Abb. 6: Kreuzungsbeziehungen zwischen den Gattungsgruppen der Ruschieae. Die zu den von Chesselet et al. 2002 abgetrennten Delospermeae gehörenden Gattungsgruppen (Bergeranthus-, Delosperma- und Stomatium-Gruppe) sind grau unterlegt. Die neuerdings vom Rest unterschiedene Gattung Drosanthemum (Tribus Drosanthemeae) ist in dieser Darstellung Teil der Delosperma-Gruppe. |
|
Wie viele andere sukkulente Pflanzengruppen auch erfreuen sich die Ruschioideae großer Beliebtheit bei Pflanzenfreunden ebenso wie bei Fachbotanikern. Diesem Umstand ist es zu verdanken, dass in der Vergangenheit zahlreiche künstliche Kreuzungen durchgeführt wurden, die über die sonst oft üblichen Zufallsprodukte hinausgehen, und dass auch am Naturstandort gezielt nach spontanen Kreuzungen gesucht wurde. Hammer & Liede (1990) berichten umfassend über die Situation. Seither sind aber zahlreiche weitere Kreuzungen hinzugekommen (siehe International Plant Names Index: www.ipni.org), so dass inzwischen die vergleichsweise hohe Zahl von 30 Gattungsbastarden bekannt ist, von denen immerhin vier auch am Naturstandort beobachtet wurden. Abb. 6 zeigt die bekannt gewordenen Kreuzungsverbindungen bezogen auf die Gruppen nach Hartmann (1998). Man sieht deutlich, dass nahezu alle Gruppen untereinander verbunden sind. Ausnahmen sind die Ruschia- und die Eberlanzia-Gruppe, von denen viele Vertreter nicht in Kultur gehalten werden. Dennoch kann man davon ausgehen, dass die zugehörigen Arten grundsätzlich kreuzbar wären und daher zum selben Grundtyp gehören, da sie auch aufgrund anderer Kriterien und besonders auch aufgrund der DNA-Sequenzvergleiche nicht aus dem Rahmen fallen. Besonders interessiert natürlich die Frage, ob die von Chesselet et al. (2002) wegen der nicht verwachsenen Nektardrüsen von den übrigen Ruschieae abgetrennten Delospermeae (Delosperma-, Stomatium- und Bergeranthus-Gruppe) auch kreuzungsmäßig getrennt sind. Wie man aus Abb. 6 ersehen kann, ist das nicht der Fall. Es bleibt die Frage, wie es sich mit der Gattung Drosanthemum verhält. Da man in Kultur die Gattung nur selten findet, gibt es leider keine entsprechenden Kreuzungen, so dass zurzeit offen bleiben muss, ob diese Gattung wegen ihrer Sonderstellung zum gleichen Grundtyp gehört. Allerdings ist die taxonomisch von Drosanthemum oft schwer abzutrennende Gattung Delosperma ebenso wie Gibbaeum aus der Delosperma-Gruppe kreuzungsmäßig mit den Ruschieae i.e.S. verbunden.
So kann zusammenfassend festgestellt werden, dass die Verwandtschaft der „Lebenden Steine“ von den Kreuzungsverbindungen ebenso wie von den morphologischen und molekularbiologischen Daten her einen Grundtyp darstellt, eventuell unter Ausschluss der Gattung Drosanthemum.
|
Literatur
- Chesselet P, Smith GF & Van Wyk AE (2002)
- A new tribal classification of Mesembryanthemaceae: evidence from floral nectaries. Taxon 51, 295-308.
- Chesselet P, Van Wyk AE & Smith GF (2004)
- Notes on African plants. Mesembryanthemaceae. A new tribe and adjustments to infrafamilial classification. Bothalia 34, 47-51.
- Hammer SA & Liede S (1990)
- Natural and artificial hybrids in the Mesembryanthemaceae. South African J. Bot. 56, 356-362.
- Hartmann HEK (1998)
- Groupings in Ruschioideae (Aizoaceae). Mesemb Study Group Bull. 13, 35-36.
- Hartmann HEK (Ed.) (2001)
- Illustrated Handbook of Succulent Plants. Aizoaceae A-E; Aizoaceae F-Z. Berlin etc.: Springer.
- Ihlenfeldt H-D (1994)
- Diversification in an Arid World: The Mesembryanthemaceae. Annu. Rev. Ecol. Syst. 25, 521-546.
- International Plant Names Index (IPNI):
- www.ipni.org (letzter Zugriff 06.2009)
- Klak C, Khunou A, Reeves G & Hedderson T (2003)
- A phylogenetic hypothesis for the Aizoaceae (Caryophyllales) based on four plastid DNA regions. Amer. J. Bot. 90, 1433-1445.
- Klak C, Reeves G & Hedderson T (2004)
- Unmatched tempo of evolution in Southern African semi-desert ice plants. Nature 427, 63-65.
- Landrum JV (2001)
- Wide-band tracheids in leaves of genera in Aizoaceae: the systematic occurrence of a novel cell type and its implications for the monophyly of the subfamily Ruschioideae. Plant Syst. Evol. 227, 49-61.
- Schwantes G (1971)
- The classification of the Mesembryanthemaceae. In Herre H (ed) The genera of the Mesembryanthemaceae. Cape Town, South Africa: Tafelberg.
- Thiede J, Schmidt SA & Rudolph B (2007)
- Phylogenetic implication of the chloroplast rpoC1 intron loss in the Aizoaceae (Caryophyllales). Biochem. Syst. Ecol. 35, 372-380.
|
|  |
