 |
„Augenblicke“ – raffiniertes Design der Linsenaugen von Henrik Ullrich
Studium Integrale Journal
15. Jahrgang / Heft 1 - April 2008
Seite 32 - 35
|
 |
Die Herausbildung des Wirbeltierauges während der Ontogenese (individuelle Entwicklung) ist wie jedes andere Detail der Individualentwicklung ein atemberaubender Prozess. Vielschichtig vernetzte Interaktionen auf molekulargenetischer, zellulärer, histologischer und organischer Ebene tragen dazu bei, dass dieses funktionell und anatomisch beeindruckende Sinnesorgan entsteht. Dennoch wird das Linsenauge immer wieder als Beispiel für einen Konstruktionsfehler genannt, so neuerdings wieder von Hemminger (2007): „Im Falle des Wirbeltierauges ist dieser Entwicklungsweg alles Andere als ‚intelligent’, denn er führt dazu, dass die lichtempfindliche Zellschicht im Augapfel hinten liegt, ..., was die Bildschärfe verringert“ (S. 12). Diese wenig sinnvoll erscheinende, inverse (umgedrehte) Konstruktion der Netzhaut bestätigt für Hemminger zweierlei: die Richtigkeit der Abstammungslehre und die Nichtexistenz von gezielter intelligenter Planung in der Natur. Dass diese Art von Schlussfolgerungen wissenschaftstheoretisch schlichte Kategoriefehler darstellen und aus wissenschaftlicher Sicht nicht belegbar sind, macht eine aktuelle Entdeckung des zellulären Feinaufbaus der Netzhaut erneut deutlich.
|  |
|
Alles klar?
Während Charles Darwin vor knapp 150 Jahren einerseits zuversichtlich, aber doch mit der ihm eigenen Zurückhaltung über die Möglichkeit der Evolution des Auges schrieb, wird heute vielfach die Evolution der Augen als geklärt und in Einzelschritten belegbar präsentiert. So schreibt zum Beispiel Kutschera (2006, S. 231): „Durch vergleichende anatomische Studien der Augen-Varianten innerhalb rezenter Populationen (Tierarten) und systematische Homologisierung dieser Strukturen konnte die Evolution der Augen Schritt für Schritt rekonstruiert werden (z.B. bei Weichtieren, Stamm Mollusca).“
 |
Biochemische und physiologische Aus-
sagen sind prinzipiell formulierbar, ohne auf eine einzige evolutionsbiologische
Aussage zurückgreifen zu müssen. |
 |
|
Eine evolutionäre Rekonstruktion kann jedoch nicht allein durch das Aufstellen von Ähnlichkeitsreihen begründet werden. Vielmehr müssen auch die für den Wandel verantwortlichen Mechanismen offengelegt werden (vgl. Gutmann 1996; 2005). Das wird häufig ausgeblendet. Evolutionäre Rekonstruktionen, die nur auf vergleichend-anatomischen bzw. molekulargenetischen Daten beruhen und in die Evolution als bereits vorausgesetzter Tatbestand eingeht, repräsentieren nach Gutmann einen der zentralen methodischen Grundwidersprüche (1996, 81) der Synthetischen Theorie der Evolution: ihre nicht zu durchbrechende argumentative Zirkularität! Außer diesen wissenschaftstheoretischen Schwächen sind auch bereits diskutierte inhaltliche Anfragen an bisher vorgetragene Argumente für eine Evolution der Augen unverändert brisant (Neuhaus & Ullrich 2000, Ullrich et al. 2006).
|
|
Nicht verstandene biologische Strukturen – kein Argument für Evolution!
 |
| Abb. 1: Schematisches Diagramm einer Wirbeltier-Retina inklusive der Lage der neu entdeckten Müller-Zellen. Der dicke Pfeil zeigt die Richstung des einfallenden Lichts an. A Amakrine Zelle, B Biploar-Zelle, G Ganglienzelle, H Horizontalzelle, M Müller-Zelle, S Stäbchen, Z Zapfen. (Nach Adler & Farber 1986 und Franze et al. 2007) |
|
Ein häufig genutztes Argument, um Evolution als Naturtatsache plausibel zu machen, basiert auf dem Nachweis von stammesgeschichtlichen „Altlasten“ in biologischen Strukturen, wie z.B. im Wirbeltierauge. Diese „Spuren der Evolution“ seien u.a. an einer suboptimalen funktionellen anatomischen Lösung oder durch „Funktionslosigkeit“ vorhandener anatomischer Strukturen erkennbar. „Das menschliche Sehen...“, so behauptet Hemminger (2007, 13), „…ist deshalb ein geradezu klassisches Beispiel für ein (in der Summe erfolgreiches) ‚Herumbasteln’ der Evolution an unserem wichtigsten Sinnesorgan.“ Ähnlich argumentiert auch Neukamm (2006): „Evolution ist eine Serie erfolgreicher Kompromisse, auch wenn allzu oft nur irreparabel verbaute Anpassungen zustande kommen.“
Unter Bezugnahme auf die inverse Lage der Sinneszellen in der Netzhaut bei Wirbeltieraugen liest man weiter: „Nun weisen Ullrich et al. darauf hin, dass die räumliche Nähe bestimmter Zellschichten zum Außensegment der Fotorezeptoren für die Regeneration und Funktion der Netzhaut ‚unerlässlich’ sei. Dies klingt, als wüssten die Autoren über alle hypothetisch denkbaren und undenkbaren Konstruktionen genauestens Bescheid. Selbst wenn wir einmal annehmen, dass ihre Behauptung stimmt, erklärt sich dadurch aber nicht, warum die Sehzellen dem Licht abgewandt sind.“
Hier werden jedoch zwei Ebenen wissenschaftlicher Beschreibungsdiskurse argumentativ vermengt. Das Gelingen oder das Scheitern von funktionellen Erklärungen biologischer Strukturen, in unserem Beispiel also der invers aufgebauten Netzhaut, trägt nichts dazu bei, eine bestimmte Entstehungstheorie (die das „wie des woher“ erklären möchte) zu favorisieren. Das große Potential der funktionell orientiert arbeitenden Biologie liegt ja gerade darin, dass biochemische und physiologische Aussagen prinzipiell formulierbar sind, ohne auf eine einzige evolutionsbiologische zurückgreifen zu müssen (Gutmann 2005, 259). Entsprechendes gilt auch für eine Bezugnahme auf „Schöpfung“. Erst das durch die biologische Grundlagenforschung gewonnene Beschreibungswissen von Strukturen, Organen oder Organismen liefert das Material für die methodologisch immer nachgeordneten hypothetischen Rekonstruktionen ihrer Entstehung. Die zunehmende Kenntnis biologischer Sachverhalte, die wir „unter Nutzung nicht evolutionären Wissens“ erwerben, wird zur ständigen Herausforderung für evolutionsbiologische Deutungen. Und das gilt umso mehr, wenn bislang scheinbar nur evolutionsbiologisch verständlich zu machende „Altlasten“ eine solide funktionelle Erklärung gefunden haben. (Gutmann [2005, 260] versteht unter nicht evolutionärem Wissen alle genetischen, embryologischen, cytologischen, biochemischen, physiologischen, taxonomischen Beschreibungen des Lebens.)
|
|
Zellfortsätze dienen als perfekte Lichtleiter
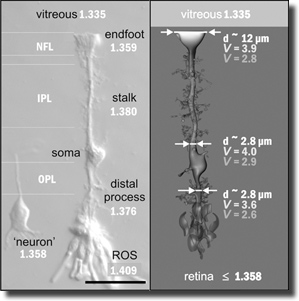 |
| Abb. 2: Aufnahme einer Müller-Zelle (vom Schwein) mittels Interferenz-Kontrast-Mikroskopie (links) und als schematische Darstellung (rechts). Aus Franzke et al. (2007), © 2007 National Academy of Sciences, USA. Die Müller-Zellen verlaufen radial zur Netzhaut und durchziehen diese in ihrer gesamten Breite. Die Fortsätze dieses besonderen Typs von Gliazellen dienen als Lichtleiter, die einen nahezu verlust- und verzerrungsfreien Transport des Lichts zu den äußeren Segmenten (ROS) der optischen Sinneszellen garantieren. Rechts: Einzelne Zellschichten (NFL, IPL, OPL) der Netzhaut mit ihrem jeweiligen Brechungsindex. Links: Brechungsindices (V-Wert) für rotes und blaues Licht in unterschiedlichen Abschnitten eines Fortsatzes der Müller-Zelle. Trotz der unterschiedlichen V-Werte und der divergierenden Durchmesser (d) in den einzelnen Bereichen des Fortsatzes erfolgt der Lichttransport ohne Kapazitätsverluste. vitreus: Glaskörper (dem Licht zugewandte Seite der Retina). Messbalken: 25 Mikrometer. |
|
Biologische Zellen sind meist transparent, aber Licht, welches durch sie hindurch tritt, wird gebrochen, reflektiert oder gestreut. Die Lichtsinneszellen bei Wirbeltieraugen liegen an der dem Licht abgewandten Seite des Schichtpaketes der Netzhaut (inverse Lage), was zu einer Streuung, Schwächung und Verzerrung des eintretenden Lichtes führen müsste (vgl. Abb. 1). Erstaunlicherweise beträgt der tatsächlich hervorgerufene Verlustanteil aber nur 1-5% des auf die Netzhaut auftreffenden Lichtes (Franzke et al. 2007). Sinnesphysiologische Untersuchungen belegen weiterhin eine hohe und präzise Sensibilität und Abbildungsschärfe des optischen Systems im Wirbeltierauge, die der von digitalen Kameras weit überlegen ist. Der biochemische und elektrophysiologische Prozess zur Umwandlung von Lichtenergie in winzige Membranströme, die dann über die Nervenbahnen als entsprechend getriggerte Impulse an das Gehirn weitergereicht werden, dokumentiert eine bis auf die Mikroebenen nachweisbare hohe systemische Vernetzung und Feinjustierung des Sehvorganges. Die embryonale Entwicklung der Netzhaut im Wechselspiel mit der Herausbildung des Gehirns und des Gesichtes sowie die bereits angesprochenen ernährungsphysiologischen Aspekte stellen alles andere als eine Kompromisslösung dar (vgl. Ullrich et al. 2006).
Wie gelingt es also dem Auge, trotz oder gerade mit dem vermeintlichen Konstruktionsfehler der inversen „Netzhaut“ diese Leistungsfähigkeit zu garantieren? Eine Arbeitsgruppe um K. Franzke vom Leipziger Institut für Hirnforschung konnte durch ausgeklügelte Messreihen mit phototechnischen Spezialinstrumenten an der Netzhaut von Schweinen klären, warum die Lichtstrahlen beim Durchtritt durch die Netzhaut bis zum Erreichen der Sinneszellen nicht die erwartete Abschwächung und Streuung erfahren. Den Schlüssel liefert eine besondere Zellgruppe des Nervensystems: die so genannten Glia-Zellen. Sie bilden mit den Neuronen (den eigentlichen Nervenzellen) das Hirngewebe bzw. das Gewebe des Rückenmarks. Ihr Anteil an der Gesamtzellmasse des Nervengewebes beim Menschen beträgt beachtliche 50%. Schätzungen gehen davon aus, dass ihre Anzahl ca. 10-50 mal höher ist als die der Neuronen. Glia-Zellen entpuppen sich mehr und mehr als Multifunktionstalente. Sie formen das strukturelle Stützgerüst für die Nervenzellen. Weiterhin sorgen Glia-Zellen für die gegenseitige elektrische Isolation und Abschirmung der Neuronen und Nervenfasern, ihre Versorgung mit Nährstoffen und den Abtransport von Stoffwechselendprodukten. Auch ihre Beteiligung an den Prozessen der Infektionsabwehr sowie der Informationsverarbeitung, -speicherung und -weiterleitung im Nervensystem konnte in den letzten Jahren bestätigt werden.
In der Netzhaut des Wirbeltierauges, die einer Art ausgestülptem Anteil des Gehirns entspricht, findet sich eine besondere Gruppe von Glia-Zellen. Diese sog. Müller-Zellen nehmen etwa 20% des Gesamtzellvolumens der Netzhaut ein (Abb. 2). Neben den o.g. Funktionen von Glia-Zellen dienen zusätzlich röhrenartig gestaltete Zellfortsätze der Müller-Zellen, wie Franze et al. nachweisen konnten, als optische Lichtleiter. Die angesprochenen Fortsätze verlaufen senkrecht zur Oberfläche der Netzhaut und damit parallel zum Lichteinfall und zeigen eine in Richtung der Sinneszellen (Stäbchen, Zapfen) zunehmende trichterförmige Einengung. Die auf diese Weise erreichte Optimierung der Refraktion (Fähigkeit des scharfen Sehens) und der Vermeidung von Rückreflexion und Streuung des
Lichtes verleiht diesen Zellen nach Ansicht der Autoren zu Recht den Titel von „ingeniously designed light collectors“ – geistreich designten Lichtsammlern. Im Durchschnitt ist jede Müller-Zelle bei Säugetieren auf diese Weise mit jeweils einer Zapfenzelle (verantwortlich für das Farbsehen und das scharfe Sehen unter Bedingungen bei Tageslicht) verbunden. Die Anzahl der mit den Müller-Zellen verbundenen Stäbchenzellen (verantwortlich für das Sehen unter Bedingungen bei Dämmerung und Dunkelheit) ist artspezifisch verschieden. Beim Menschen wie beim Schwein werden ca. 10 Stäbchenzellen über eine Müllerzelle effektiv mit Licht „versorgt“.
|
|
Mythos „Konstruktionsfehler“
Die durch Franze et al. beschriebenen Funktionen der Müller-Zellen zeigen eindrucksvoll, dass auch die inverse Retina (Netzhaut) für sich selbst als ein optimiertes optisches System beurteilt werden muss. Die Retina ist darüber hinaus integraler Bestandteil in einem anatomisch und funktionell hochleistungsfähigen System.
Nicht nachvollziehbar ist es, dass Hemminger in dem o.g. Text einerseits auf diese Entdeckung von Franzke hinweist, aber dennoch beharrlich dabei bleibt, die Retina mit Struktur- und Funktionsmängeln behaftet zu präsentieren. Die jetzt bekannten empirischen Fakten entziehen einer solchen Argumentation die Grundlage. Der durch wissenschaftliche Erkenntnislücken bisher am Leben erhaltene Mythos vom „Konstruktionsfehler“ des Wirbeltierauges ist damit nicht mehr nötig, um die Funktion und den Aufbau der Netzhaut, die sich „ingeniously designed“ präsentiert, zu charakterisieren.
Die Evolutionsbiologie wird so ein weiteres Mal durch den Erkenntnisfortschritt herausgefordert, plausible Erklärungen ihrer Grundthese zu geben, dass biologische Strukturen wie die Netzhaut zwar „designt“ erscheinen, aber dennoch nicht designt seien. Die Inanspruchnahme von Nichtwissen funktioneller Zusammenhänge erweist sich dabei wohl als das schlechteste aller möglichen Argumente.
|
Literatur
- Adler R & Farber D (1986)
- The Retina. New York.
- Fernald RD (2006)
- Casting a Genetic Light on the Evolution of Eyes. Science 313, 1914-1918.
- Franze K et al. (2007)
- Müller cells are living optical fibers in the vertebrate retina. Proc. Natl. Acad. Sci. 104, 8287-8292. (online: http://www.pnas.org/cgi/reprint/104/20/8287)
- Gutmann M (1996)
- Die Evolutionstheorie und ihr Gegenstand. Berlin: Verlag für Wissenschaft und Bildung.
- Gutmann M (2005)
- Begründungsstrukturen von Evolutionstheorien. In: Krohs U & Toepfer G (Hg) Philosophie der Biologie. Frankfurt/M, S. 249-266.
- Hemminger H (2007)
- Mit der Bibel gegen die Evolution. EZW-Texte Nr. 195. Berlin.
- Kutschera U (2006)
- Evolutionsbiologie. Stuttgart.
- Neukamm M (2006)
- Das Auge und die inverse Lage der Netzhaut – ein Design-Signal? www.evolutionsbiologen.de/inversauge.html
- Ullrich H, Winkler N & Junker R (2006)
- Zankapfel Auge. Ein Paradebeispiel für „Intelligent Design“ in der Kritik. Studium Integrale Journal 13, 3-14.
- Winkler N & Ullrich H (2000)
- Das Wirbeltierauge – Ein Konstruktionsfehler ohne funktionellen Sinn? Studium Integrale Journal 7, 3-11.
-
|
|  |
