 |
Geburtshelfer in der Ursuppe?
„PNA-Welt“ – plausibler als eine „RNA-Welt“?
von Kurt Weindel
Studium Integrale Journal
12. Jahrgang / Heft 2 - Oktober 2005
Seite 65 - 69
|
 |
Zusammenfassung: Die RNA-Welt als häufig zitierte Hypothese zur Lebensentstehung weist aufgrund chemischer Befunde gravierende Mängel auf. Unspezifische Synthesen mit geringen Ausbeuten und komplexen Produktgemischen mit überwiegend unbrauchbaren Nebenprodukten verringern die Erklärungskraft ebenso wie die geringe Lebensdauer von Zwischenprodukten, die damit für nachfolgende Syntheseschritte nicht mehr zur Verfügung stehen. Daher wird nach einfacheren Vorstufen gesucht und dafür die sog. PNA-Welt vorgeschlagen (PNA steht für peptide nucleic acid; Nukleinsäuren mit einem Rückgrat aus Peptiden). Eine kritische Untersuchung der PNA-Welt zeigt jedoch, daß einige wenige Probleme der RNA-Welt zwar gelöst werden können, dies aber auf Kosten von noch mehr neuen Problemen erfolgt, so daß insgesamt keine größere Plausibilität für eine PNA-Welt gegenüber einer RNA-Welt erreicht wird.
|
 |
|
RNA-Welt
Die Entdeckung, daß Information vermittelnde Nukleinsäuren (RNA) auch katalytische Funktionen aufweisen können, gab einen wesentlichen Anstoß für die Hypothese der RNA-Welt, die sich in aktuellen Darstellungen zur Lebensentstehung großer Attraktivität erfreut. Denn damit hofft man das präbiotische „Henne-Ei-Problem“ lösen zu können: Was war zuerst da – „Henne“ (Proteine, die für den Stoffwechsel benötigt werden) oder „Ei“ (Nukleinsäuren DNA oder RNA für Vererbung bzw. Replikation)? Beides wird gleichzeitig benötigt. Ein Molekül wie die RNA, das beide Fähigkeiten in sich vereinigt, scheint verheißungsvoll zu sein.
 |
Es gibt bislang keinen plausiblen
Vorschlag für die Synthese erster
langkettiger Nukleinsäuren ohne
Rückgriff auf chemisches Know-how. |
 |
|
Die chemischen Eigenschaften von RNA-Molekülen werfen jedoch ernsthafte Fragen und Probleme für die präbiotische Chemie auf. Für eine vertiefende Betrachtung siehe Weindel (2001). So gibt es gegenwärtig keinen plausiblen Vorschlag für die unabdingbar notwendige Synthese erster langkettiger Nukleinsäuren ohne Rückgriff auf chemisches Know-how und entsprechend gezielte Ausführung der Synthesen. Reaktionen, die Komponenten zum Aufbau von RNA liefern, ergeben komplexe Produktgemische, in denen der Anteil des gewünschten Produkts oft sehr gering ist. Viele der Bausteine zerfallen, d.h. sie sind chemisch nicht ausreichend stabil, und stehen damit für den Aufbau von RNA-Molekülen unter Ursuppenbedingungen (d.h. ohne Synthese-Know-how) nicht zur Verfügung. Aus diesen Gründen wird intensiv nach einfacheren Vorläufern von RNA oder nach chemisch ähnlichen Alternativen gesucht.
|
|
Eine Alternative: PNA statt RNA
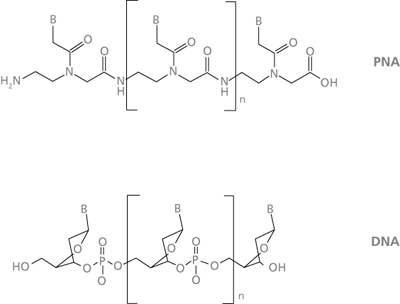 |
| Abb. 1: Allgemeine Darstellung von PNA- und DNA-Strängen, unter Hervorhebung der strukturellen Ähnlichkeit. B = Nucleobase. |
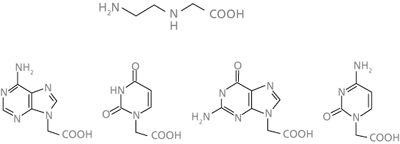 |
| Abb. 2: Die Bausteine für PNA-Stränge: N-(2-aminoethyl) glycin und die N1- bzw. N9-Essigsäure-Derivate der Pyrimidin- bzw. Purinbasen. |
|
Die genannten kritischen Befunde werden teilweise auch von Befürwortern der Evolutionslehre angesprochen. Als Konsequenz legen einige Kritiker Überlegungen zu einer „PNA-Welt“ als verheißungsvolle Alternative vor, so z.B. eine Gruppe um Veteran Stanley L. Miller (Nelson et al. 2000). Peptide Nukleinsäuren (PNA) sollen demnach anstelle der RNA das erste Erbmaterial gebildet haben. Könnte eine PNA-Welt Geburtshelfer bei der erstmaligen, abiogenetischen Entstehung des Lebens gewesen sein und löst die PNA-Welt die Probleme der RNA-Welt? Wenn ja, stellt sich weiter die Frage, wie der Übergang von PNA zur RNA erfolgt sein könnte.
PNA (peptide nucleic acid oder polyamide nucleic acid) sind Analoga natürlicher Nukleinsäuren, bei denen das Zuckerphosphat-Rückgrat komplett ausgetauscht ist gegen ein Strangrückgrat aus N-(2-aminoethyl)glycin-Bausteinen, also Abkömmlinge der achiralen Aminosäure Glycin (siehe Abb. 1 und 2). Diese stereochemische Einfachheit des Rückgrats unter Aufrechterhaltung von Hybridisierungsfähigkeit und DNA-ähnlicher Polymerstruktur hatte seit Beginn der PNA-Arbeiten ab den 1990er Jahren Spekulationen genährt, PNA könnte eine Vorstufe heutiger Nukleinsäuren unter den Bedingungen einer primitiven Erde gewesen sein. Nun wurde von Nelson et al. (2000) die Möglichkeit aufgezeigt, daß sowohl der PNA-Rückgrat-Baustein N-(2-aminoethyl)glycin (AEG) als auch die Essigsäure-Derivate (Acetate) der 4 natürlichen Nucleobasen unter simulierten Ursuppenbedingungen entstehen können. Etwas genauer:
- Unter 4 verschiedenen Reaktionsbedingungen entstanden zwar nur geringste Spuren an AEG (ca. 10-5 % Ausbeute), in einem Ansatz (Polymerisation von 8,3 M NH4CN in Gegenwart von 0,8M Formamid) entstanden jedoch ca. 0,05% Ethylendiamin (ED), was als äquivalent zu AEG gewertet wurde, da ED durch die sog. Strecker-Synthese in AEG umgewandelt werden kann. Zudem werden hohe AEG-Konzentrationen in Ursuppen als plausibel angesehen, da ED auch photochemisch durch die Einwirkung von UV-Licht auf CH4, NH3 und H2O gebildet werden kann. Bezüglich der Bildung von AEG aus ED ist jedoch zu beachten, daß mit steigender Konzentration an ED und fortschreitender Reaktionsdauer die Ausbeute an AEG sinkt, da vermehrt Ethylendiamin-diacetat gebildet wird.
- Adenin- und Guanin-N9-acetate wurden durch Erhitzen von 2,5 M Glycin, 7,5 M NH4OH und 10 M NaCN mit 0,0062% bzw. 0,011% Ausbeute im Gemisch mit weiteren Reaktionsprodukten angeliefert. Dieser Syntheseweg verlangt jedoch die Ausblendung von UV-Licht, da es zu störenden Umlagerungsreaktionen führen würde. Er erfordert also teilweise gegensätzliche Bedingungen wie die oben beschriebene photochemische Entstehung von ED.
- Cytosin- und Uracil-N1-acetate wurden mit 18 bzw. 1,8% Ausbeute erhalten durch Reaktion von 1 mM Cyanoacetaldehyd und 2 M Hydantoin (ein Harnstoff-Derivat) bei 100 °C, wiederum begleitet von Nebenprodukten, z.B. 14 % Cytosin-N3-acetat.
- AEG kann bei Erhitzen auf 100 °C polymerisieren unter Bildung entsprechender Oligomere (die Reaktionsbedingungen und -produkte sind nicht näher beschrieben worden).
|
|
Kritik
Aus dem heute verfügbaren Gesamtbild bezüglich der Eigenschaften von PNA ergibt sich eine Reihe von kritischen Anmerkungen zur Plausibilität einer „PNA-Welt“.
Genügende Anlieferung der benötigten Zwischenprodukte? Die benötigen Stoffe werden teilweise in nur sehr geringer Ausbeute erhalten – trotz Einsatz von z.T. extrem hohen Konzentrationen an gereinigten Ausgangsstoffen und trotz Einhaltung der jeweils günstigen Reaktionsbedingungen und Verminderung kontraproduktiver Nebenreaktionen. Das sind keine realistischen Ursuppenbedingungen.
Schutzgruppenstrategie. Für das korrekte Zusammenfügen von jeweils einem Rückgratbaustein AEG und einer acetylierten Nucleobase ist es von entscheidender Bedeutung, diejenigen funktionellen Gruppen, die dabei nicht reagieren sollen, mit Schutzgruppen zu versehen, die während der Umsetzung stabil, danach aber unter möglichst milden Bedingungen wieder abspaltbar sein müssen, so daß intakte Monomere (Einzelbausteine) und daraus dann Oligomere (Moleküle geringer Kettenlänge) entstehen können. Unerwünschte Nebenreaktionen, die unterdrückt werden müssen, sind z.B. Acyl-Transferreaktionen (Wanderung von Nucleobase-Acetaten an falsche Positionen), Abspaltung von N-terminalen PNA-Monomeren, Blockierung der für Basenpaarung benötigten Funktionen (Verlust der Hybridisierungsfähigkeit) oder Kettenverlängerungen an falschen Stellen (d.h. es entstehen keine linearen Stränge). Dies betrifft vor allem die Aminogruppen außerhalb der Ringsysteme der Nucleobasen (die 4-Aminogruppe des Cytosin, die 6-Aminogruppe des Adenins und die 2-Aminogruppe des Guanins), sowie die jeweils endständige Amino- bzw. Carboxygruppe von N-(2-aminoethyl)glycin. Dazu ist eine Menge an spezifischem Know-how und speziellen Reagenzien erforderlich. So gelingt dies z.B. bei Cytosin gut mit Benzyloxycarbonylchlorid. Dieses funktioniert aber bei Adenin ganz schlecht; hier arbeitet man stattdessen mit dem „Exoten“ N-(benzyloxycarbonyl)-N’-ethylimidazolium-tetrafluoroborat. Um Guanin einigermaßen spezifisch an der N9-Position acetylieren zu können, geht man von 2-Amino-6-chloro-purin aus, und setzt erst später die 6-Chlor- in die normale 6-Oxogruppe um. Dies vermindert die konkurrierende Kopplung an die N3-Position. Selbst die eigentlich einfache Acetylierung bedarf geeigneter Reagenzien (i.d.R. Ethyl-bromoacetat, mit Na-Hydrid anionisiert und so aktiviert). Ohne ein gekonntes Synthesedesign und Einsatz maßgeschneiderter Reagenzien ist die Darstellung von brauchbaren PNA-Monomeren kaum vorstellbar.
Dieser entscheidende Gesichtspunkt wird von Nelson et al. (2000) völlig außer acht gelassen. Das gilt auch für den folgenden Einwand.
Bedarf an Aktivierungsreagenzien für die Kopplungreaktionen. Die Essigsäure-Derivate der Nucleobasen müssen spezifisch an die ungeschützt bleibende sekundäre Aminogruppe in der Mitte der AEG-Moleküle gekoppelt werden. Dazu bedarf es der Aktivierung durch ziemlich spezielle Reagenzien wie DhbtOH (3,4-Dihydro-3-hydroxy-4-oxo-1,2,3-benzotriazin) oder PyBrop (Bromo-tris (pyrrolidino)phosphonium-hexafluorophosphat).
Ähnliches gilt für die nachfolgende Oligomersynthese aus den zuvor gebildeten PNA-Monomeren. Diese gelingt nur mit Hilfe von Hilfsreagenzien. So koppelt das Thymin-Monomer gut, wenn es als Pentafluorophenylester aktiviert ist. Kopplung von Cytosin-Monomeren hingegen verlangt nach in situ-Aktivierung durch Carbodiimid-Agentien, ebenso wie die anderen Monomere. Am besten aber geht es mit allen Monomeren unter Einsatz von „Exoten“ wie HATU [O-(7-Azabenzotriazol-1-yl)-1,1,3,3-tetramethyluronium-hexafluorophosphat].
Allein die Bezeichnungen der Reagenzien machen schon deutlich (und deshalb werden sie genannt), daß eine nennenswerte PNA-Synthese unter den Bedingungen einer primitiven Erde sehr unwahrscheinlich ist.
|
Eine unverzichtbare Voraussetzung für Leben betrifft die genaue räumliche Gestalt lebensnotwendiger Moleküle. Aminosäuren, Zucker und sehr viele andere Lebens-Bausteine kommen in der Natur einheitlich in einer von zwei spiegelbildlichen Formen vor (optische Reinheit). Zur biochemischen Aktivität ist eine bestimmte und einheitliche räumliche Struktur unbedingt erforderlich. In Verbindung mit spiegelbildlichen Molekülformen spricht man auch von „Chiralität“, das heißt übersetzt „Händigkeit“, denn die Hände sind ein anschauliches Beispiel für chirale Objekte, die räumlich nicht zur Deckung zu bringen sind. Zwei zueinander spiegelbildliche Moleküle heißen „Enantiomere“, ein 1:1-Gemisch zweier Enantiomere nennt man „Racemat“. So ähnlich sich Enantiomere auch sind, können sie sich gegenseitig nicht ersetzen. Reine Enantiomere können im Labor mit entsprechendem Know-how hergestellt werden, entweder direkt auf synthetischem Wege, oder durch Trennung racemischer Gemische. Liegen (wie z.B. in Ursuppen) nur achirale Ausgangsmaterialien vor, so muß die chirale „Information“ in irgendeiner Weise chemisch hineingebracht werden, sonst entstehen wieder nur Racemate.
|
Begrenzte Löslichkeit in wässrigem Milieu. PNA ist bedeutend hydrophober (weniger wasserlöslich) als DNA oder RNA. Bereits mit relativ kleinen Oligomeren (z.B. aus 14-18 Monomeren aufgebaut) treten Löslichkeitsprobleme, unspezifische Bindungsphänomene oder Selbstaggregation von PNA-Molekülen auf. So werden auch die oben beschriebenen Synthesereaktionen typischerweise in organischen Lösungsmitteln durchgeführt (z.B. Mischungen von Dichlormethan und Dimethylformamid oder Piperidin). Wenn man bedenkt, daß eine PNA, welche nur eine einfache Polymerase codiert, bereits mehrere Hundert Bausteine benötigt, so wird klar, daß ein „PNA-Genom“ mit dem physiologischen Milieu lebender Zellen schwer verträglich ist. Es sei angemerkt, daß PNA immerhin so polar ist, daß sie Biomembranen per passiver Diffusion kaum durchqueren kann.
 |
| Grosses Bild |
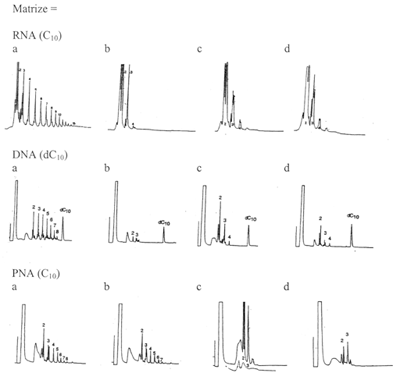
| Abb. 3: Stereochemische Komplikationen (enantiomere Kreuz-Inhibition). Für die zur replikativen Synthese angebotenen G-Bausteine (aktiviert in Form des 5’-Phospho-Imidazol-Derivats) gilt jeweils: a = reine D-Bausteineb = reine L-Bausteine c = D-/L-Gemisch, beide Bausteine in derselben Konzentration wie solo in a bzw. b. d = D-/L-Gemisch, mit reduzierter Konzentration, so daß sich für D+L maximal dieselbe Gesamtkonzentration wie in a bzw. b ergibt |
|
Stereochemische Komplikationen. Da das AEG-Rückgrat achiral ist (d. h. es gibt bei diesem Molekül im Gegensatz zur Ribose keine spiegelbildlichen Strukturvarianten), gab es Hoffnungen, PNA könnte manche Probleme der „RNA-Welt“ lösen. Dies betrifft insbesondere die Bildung optisch reiner Produkte (zur optischen Reinheit siehe Kasten). Experimentelle Untersuchungen unterstützen diese Hoffnungen jedoch nicht. An optisch reinen RNA- (oder DNA-) Matrizen (in deren Rückgrat die Kohlenhydrate Ribose bzw. Desoxyribose also ausschließlich in D- oder L-Form vorliegen) erfolgt keine replikative Synthese eines ebenfalls optisch reinen Tochterstranges, wenn die Ribonukleosid-Bausteine (typischerweise in einer Konzentration von 0,01-0,1 mol/l angeboten) als Mischung spiegelbildlicher Moleküle vorliegen. Es entsteht sogar überhaupt kein Tochterstrang, sondern nur sehr kurze Stücke infolge von Strangabbruch (enantiomere Kreuz-Inhibition). Wie ist es nun mit einer Mischung von D-/L-Ribonukleotiden, wenn die Matrize nun PNA statt RNA oder DNA ist, die also stereochemisch „blind“ ist? In Abb. 3 ist gezeigt, daß an RNA- bzw. DNA Matrizen nur bei Zugabe der passenden Bausteine Tochterstränge gebildet werden; gibt man sowohl D- als auch L- Bausteine zu, unterbleibt dies. Bei PNA bilden sich sowohl bei Zugabe von D- als auch bei Zugabe von L-Bausteinen Tochterstränge; Gemische ergeben jedoch wiederum keine Tochterstränge.
Es bleibt also die Forderung nach Enantiomerentrennung vor dem Kopiervorgang an der Matrize, und dies in einer Umgebung aus racemischen oder achiralen Ursuppenbestandteilen. Dafür ist bis jetzt keine Lösung in Sicht. Eine PNA-Welt taugt demnach nicht als „Geburtshelfer“ für eine RNA-Welt.
Enzymatische Aspekte. PNA-Bausteine können von Polymerasen (Enzyme zur Verlängerung von Molekülketten) nicht verarbeitet werden, und wirken daher als Kettenabbrecher. PNA kann von Nucleasen und Proteasen nicht abgebaut werden. Zwischen bekannten Enzymen und PNA ist also bisher keine Wechselwirkung bekannt. Es gibt offenbar keine biochemische „Erinnerung“ mehr an eine PNA-Welt (weder anabolisch noch katabolisch), oder es hat sie nie gegeben.
 |
Die hypothetische PNA-Welt
ist ein Schritt weiter weg von
der realen, beobachtbaren Biochemie. |
 |
|
Besonderheiten bezüglich Hybridisierung. PNA hybridisiert mit einzelsträngiger DNA nicht nur (wie bei DNA/RNA üblich) komplementär anti-parallel (N-Terminus ~3’-Ende, d.h. die beiden Einzelstränge weisen im Doppelstrang entgegengesetzte Richtungen auf), sondern auch komplementär parallel (N-Terminus ~5’-Ende); letzteres ist i.d.R. weniger stabil. PNA mit hohem Pyrimidingehalt vermag außerdem sehr stabile Tripelhelices aus zwei PNA-Ketten und einer DNA-Kette [(PNA)2:DNA)] zu bilden durch sog. Stranginvasion. Bei GC-reichen Sequenzen bilden sich hingegen eher PNA:(DNA)2-Tripelhelices. Solche Triplex-Segmente können von RNA-Polymerasen nicht überwunden werden, besonders wenn der Matrizenstrang einbezogen ist; es kommt zum Transkriptionsabbruch. Und schließlich: der Einbau einer einzigen chiralen Aminosäure am C-Terminus einer ansonsten achiralen PNA hat großen Einfluß auf entstehende Hybride: Aminosäuren mit entgegengesetzter Konfiguration (D, L) ergeben Doppelhelices mit entgegengesetzter Orientierung („Händigkeit“). Diese gegenüber DNA/RNA geringere Bestimmtheit in Bezug auf Hybridisierungsprodukte und deren Strukturen wäre für eine ungelenkte Selektion von Biokatalysatoren eine beträchtliche Erschwernis, ebenso wie die Wechselwirkungen zwischen PNA und DNA für eine zu fordernde Übergangsphase, in der beide Nukleinsäuresorten nebeneinander existierten. Eine DNA/RNA-spezifische Enzymentwicklung würde behindert.
|
|
Schlußfolgerung
Eine hypothetische „PNA-Welt“ löst (mit Ausnahme der größeren chemischen Stabilität von AEG gegenüber Zuckern) nicht die vielfältigen Probleme einer ebenfalls hypothetischen „RNA-Welt“. Im Gegenteil: sie verlangt nach zusätzlichen Übergangsszenarien sowohl auf der Ebene des genetischen Materials (Informationsträger) als auch auf der Ebene der Genprodukte (enzymatische Werkzeuge). Sie ist ein Schritt weiter weg von einer realen, beobachtbaren Biochemie. Wesentlich plausibler als PNA- oder RNA-Welten ist die Annahme eines kreativ wirkenden und lenkenden Chemo-Designers.
|
Literatur
- Bonham MA, Brown S, Boyd AL, Brown PH, Bruckenstein DA, Hanvey JC, Thomson SA, Pipe A, Hassman F, Bisl JE, Froehler BC, Matteucci MD, Wagner RW, Noble SA & Babiss LE (1995)
- An assessment of the antisense properties of RNase H-competent and steric-blocking oligomers. Nucleic Acids Res. 23, 1197-1203.
- De Mesmaker A, Altmann KH, Waldner A & Wendeborn S (1995)
- Backbone modifications in oligonucleotides and peptide nucleic acid systems. Curr. Opin. Struct. Biol. 5, 343-355.
- Dueholm KL, Eghol M, Behrens C, Christensen L, Hansen HF, Vulpius T, Petersen KH, Berg RH, Nielsen PE & Buchardt O (1994)
- Synthesis of Peptide Nucleic Acid Monomers Containing the Four Natural Nucleobases: Thymine, Cytosine, Adenine, and Guanine and Their Oligomerization. J. Org. Chem. 59, 5767-5773.
- Joyce G, Visser GM, van Boeckel CAA, van Boom JH, Orgel LE & van Westrenen J (1984)
- Chiral selection in poly(C)-directed synthesis of oligo(G). Nature 310, 602-604.
- Nelson KE, Levy M & Miller SL (2000)
- Peptide nucleic acids rather than RNA may have been the first genetic molecule. PNAS 97, 3868-3871.
- Egholm M, Buchardt O, Nielsen PE & Berg RH (1992)
- Peptide nucleic acids (PNA). Oligonucleotide analogues with an achiral peptide backbone. J. Am. Chem. Soc. 114, 1895-1987.
- Egholm M, Buchardt O, Christensen L, Behrens C, Freier SM, Driver DA, Berg RH, Kim SK, Norden B & Nielsen PE (1993)
- PNA hybridizes to complementary oligonucleotides obeying the Watson–Crick hydrogen-bonding rules. Nature 365, 566-568.
- Schmidt J, Nielsen PE & Orgel LE (1997)
- Enantiomeric Cross-Inhibition in the Synthesis of Oligonucleotides on a Nonchiral Template. J. Am. Chem. Soc. 119, 1494-1495.
- Uhlmann E, Peyman A, Breipohl G & WillDW (1998)
- PNAs: synthetische Polyamidnucleinsäuren mit außergewöhnlichen Bindungseigenschaften. Angew. Chem. 110, 2954-2983.
- Weindel K (2001)
- „RNA-Welt“ – Chemisches Missing Link zwischen Ursuppe und ersten Zellen? Stud. Int. J. 8, 72-80.
- Wittung P, Kajanus J, Edwards K, Nielsen PE, Norden B & Malmström BG (1995)
- Phospholipid membrane permeability of peptide nucleic acid. FEBS Letters 365, 27-29.
|
|  |
