 |
Baum, Baukasten, Netzwerk
Ist die evolutionäre Systematik zirkelschlüssig? von Reinhard Junker
Studium Integrale Journal
10. Jahrgang / Heft 1 - April 2003
Seite 3 - 11
|
 |
Zusammenfassung: Heute sind mindestens zwei Millionen Arten von Lebewesen bekannt. Die enorme Vielfalt der Lebewesen zeigt kein chaotisches Muster, sondern läßt sich nach verschiedenen Kriterien sinnvoll ordnen. Schon vor der Etablierung der Evolutionsanschauung in der Biologie hatten sich hierarchische Ordnungsmuster bewährt. Folgt man den Vorgaben der Evolutionslehre, wonach die Arten durch Abwandlungen und Verzweigungen auseinander hervorgegangen sind, ist primär zu erwarten, daß sich diese Vielfalt baumförmig darstellen läßt (Stammbäume). Durch diese Erwartung sind entsprechende Verfahren der phylogenetischen Rekonstruktion wie die Cladistik motiviert.
Kann die Vielfalt der Arten auch unter Prämissen der Schöpfungslehre geordnet werden? Welche Erwartungen an die Ordnungsmuster können gestellt und geprüft werden? Ein wissenschaftstheoretisches Standardargument gegen diesen Ansatz lautet, mit „Schöpfung“ könne man jegliche Ordnungsmuster erklären; auch die Abwesenheit irgendeines Musters. Schöpfung erkläre alles und damit nichts.
Doch so einfach stellt sich die Sachlage bei näherer Betrachtung nicht dar. Zum einen widersprechen die Merkmalsmuster der Arten vielfach ursprünglichen evolutionstheoretischen Erwartungen. So lassen sich die Beziehungen zwischen Angehörigen bestimmter Tier- und Pflanzengruppen nicht selten besser netzartig als baumartig darstellen. Man kann zwar versuchen, die Evolutionstheorie soweit zu ändern, daß diesen Befunden Rechnung getragen wird (was bisher allenfalls teilweise gelingt), doch nähert man sich damit der Situation, daß durch Evolution ebenfalls alle denkbaren Muster im Prinzip deutbar sind.
Zum anderen ist es durchaus möglich, aus Vorgaben der Schöpfungslehre konkrete, prüfbare Folgerungen für das zu erwartende Merkmalsmuster abzuleiten. Jede systematische Arbeit ist durch philosophische Vorgaben geleitet, und letztlich sind immer nur Deutungen im nachhinein, jedoch keine zwingenden Vorhersagen möglich. Der nachfolgende Beitrag geht dieser Problematik nach.
|  |
|
Einleitung und Fragestellung
Wie und warum läßt sich die Vielfalt der Lebewesen ordnen und woran soll man sich bei der Erstellung einer Ordnung orientieren? Der Vergleich der Organismen deckt eine abgestufte Ähnlichkeit auf, die es erlaubt, die Lebewesen in einer hierarchischen Weise taxonomisch* zu ordnen (Abb. 1) (Mit Stern versehene Begriffe finden sich im Glossar). Dieser nicht selbstverständliche Befund1 ist schon lange erkannt worden, bereits vor der Veröffentlichung von DARWINs Evolutionstheorie. Die Abstammungslehre sollte eine Erklärung für diese Ordnung der Lebewesen ermöglichen: Die Abstufung des Ausmaßes der Ähnlichkeiten zwischen den Arten soll demnach tendentiell das Ausmaß der Auseinanderentwicklung der Arten widerspiegeln. Im Gefolge der Abstammungslehre hat sich folgerichtig das Baumschema als Darstellungsmittel der Ähnlichkeitshierarchie eingebürgert.2 Dagegen wurden in der Vergangenheit auch andere Darstellungen verwendet, z. B. Stufenleitern oder Netzschemata (vgl. Abb. 3).
 |
| Abb. 1: Ordnung der Lebewesen in einem hierarchischen, enkaptischen System, am Beispiel von Riesengleithörnchen (P. petaurista), Eichhörnchen (Sc. vulgaris) und Wolf (C. lupus). (Nach PETERS & GUTMANN 1971) |
|
Die Tatsache, daß die Ähnlichkeitsmuster der Arten eine hierarchische oder verschachtelte Ordnung erlauben, wurde vor DARWIN im Rahmen von Schöpfungsvorstellungen nicht als problematisch empfunden. Heute ist dies anders, denn man glaubt, mit der Evolutionslehre eine wissenschaftliche Erklärung für diesen Befund bieten zu können, was für die Schöpfungslehre nicht gelte. So ist MAHNER (2002) der Auffassung: „Gewiss würde auch eine Schöpfungstheorie die abgestufte Ähnlichkeit der Arten, wie sie sich in der biologischen Systematik darstellt, erklären: Gott hat eben ähnliche Arten geschaffen. Und, so fragen die Kreationisten, ist diese Ähnlichkeit nicht gerade Beweis für die Handschrift desselben Baumeisters? Leider nein, denn eine auf Schöpfung basierende Theorie könnte auch den genau gegenteiligen Fall erklären, nämlich den, dass es keinerlei Ähnlichkeit zwischen den Arten gäbe: Gott hätte dann eben unähnliche Arten geschaffen. (In diesem Falle wäre die Idee einer Evolution wohl gar nicht erst aufgekommen.)“ Daher müsse ein „wissenschaftlicher Kreationismus“ scheitern und auf einem Schöpfungsansatz basierende Theorien könnten nicht als Alternativen zur Evolutionstheorie in Frage kommen.
Makrosystematik und Grundtypen
|
|
| In diesem Beitrag geht es, wenn nicht anders vermerkt, um Makrosystematik, das heißt um Systematik* der höheren taxonomischen* Gruppen (Familie und höher). Im Rahmen der Grundtypenbiologie entspricht dies der |
Systematik verschiedener Grundtypen. Grundtypen sind alle biologischen Arten, die direkt oder indirekt durch Kreuzungen miteinander verbunden sind, wobei das Erbgut beider Elternarten ausgeprägt werden muß (SCHERER 1993). |
|
Dieses Argument ist so alt wie die DARWINsche Evolutionstheorie, denn bereits Charles DARWIN führte es in seinem Hauptwerk „Über die Entstehung der Arten“ (1859, 416) an: „On the ordinary view of the independent creation of each being, we can only say that so it is; – that it has so pleased the Creator to construct each animal and plant.“
Kritiker wenden also ein, daß beliebige Erwartungen an das Merkmalsmuster der Lebewesen aus der Schöpfungslehre abgeleitet werden können; die Daten würden also immer „passen“. Die Kritik ist insofern berechtigt, als in der Tat keine eindeutigen Erwartungen aus der Schöpfungslehre abgeleitet werden können – wir kommen weiter unten darauf zurück –, aber ist die Situation bei der Evolutionslehre grundlegend anders? Im folgenden wird dieser Frage nachgegangen. Zunächst sollen jedoch einige grundsätzliche Bemerkungen zu den Voraussetzungen der Systematik* der Lebewesen vorgeschaltet werden.
|
|
Es gibt keine voraussetzungslose Systematik
Wenn die Vielfalt der Lebewesen geordnet werden soll, stellt sich die Frage, nach welchen Gesichtspunkten diese Ordnung erfolgen soll. Jeder Systematiker arbeitet mit einer bestimmten Vorstellung und Zielsetzung, die von den bloßen Daten an sich nicht erzwungen werden. So bemerken SUDHAUS & REHFELD (1992, VII) einleitend in ihrem Lehrbuch, daß eine „unvoreingenommene Betrachtung der Natur und damit auch eine theorienlose Systematik weder möglich noch erwünscht“ sei. Beobachtungen erfolgen theoriegeleitet, und die Art und Weise, wie das Ähnlichkeitsmuster der Arten erfaßt wird, hängt davon ab, welche Regelmäßigkeiten in der Natur erwartet werden (RIEPPEL 1993, 5).
Nach dem Siegeszug der Abstammungslehre soll das System der Lebewesen in der Regel dem zugrundegelegten Evolutionsgedanken gerecht werden. Der hypothetische phylogenetische Ablauf soll sich in der Systematik widerspiegeln. Die Voraussetzung evolutionärer Deutung ist in der Biologie heute zwar selbstverständlich, doch ändert dies nichts daran, daß es sich um eine Vorgabe handelt (MOORE & WILLMER 1997, 2f.). LEE (1999, 724) ist der Auffassung, daß der Versuch, die Vielfalt der Lebewesen in ein Baumschema zu bringen, nur durch Bezugnahme auf die Evolutionstheorie gerechtfertigt werden kann. Und BROWER (2000, 19) stellt ebenso wie viele andere Biologen fest, daß das grundsätzliche Prozedere des Erkennens von Homologien*, welche die Basis für eine phylogenetische Systematik bilden, sich in den letzten 200 oder mehr Jahren nicht geändert habe. Dies sei der Fall, weil die empirische Basis vom jeweiligen Deutungsrahmen – Evolution, Plan Gottes oder anderes – relativ unabhängig sei. Offenbar zwingt das Ähnlichkeitsmuster der Arten die Systematiker nicht, die Vielfalt der Lebewesen im Sinne eines evolutionstheoretischen Stammbaumes zu ordnen. Eine nicht-evolutionäre Leitanschauung in der Systematik ist daher grundsätzlich legitim.
Es gilt heute als Allgemeingut, daß ein praktikables taxonomisches System oft nicht als Widerspiegelung der Evolution angesehen werden kann. Die taxonomischen und die phylogenetischen Erfordernisse stehen häufig im Gegensatz zueinander (vgl. z. B. CRONQUIST 1987, 14; LORENZEN 1994, 200). So stehen hinter der Cladistik* und der Phänetik* „völlig verschiedene Philosophien. Die eine versucht das Evolutionsmodell der Verzweigung zu behaupten, die andere das Modell der morphologischen Ähnlichkeit“ (RIDLEY 1991, 108). Die Prozeduren in beiden Verfahren, Ordnung herzustellen, sind entsprechend verschieden. Die Philosophie, die hinter einer Systematik steckt, hat also maßgebliche Folgen für die konkrete Vorgehensweise in der Systematik.
|
|
Erwartungen an das Merkmalsmuster im Rahmen der Evolutionslehre
Baum, Baukasten, Netzwerk. Die bekannten Evolutionsmechanismen beinhalten zum einen sukzessive Abwandlungen, zum anderen Aufspaltungen von Arten. Dies begründet naheliegenderweise die Erwartung, die Vielfalt der Lebewesen hierarchisch und insbesondere in Baumform darstellen zu können. In zahlreichen Fällen ist die Darstellung von Organismengruppe in Baumdiagrammen einigermaßen stimmig; doch ist dies bei weitem nicht immer der Fall (s. u.). In der Regel weisen auch die relativ stimmigen Ähnlichkeitsbäume „Schönheitsfehler“ auf. Damit ist gemeint, daß in der Baumdarstellung einige markante Merkmale der verglichenen Lebewesen nicht in das jeweils ermittelte Verzweigungsschema passen (Inkongruenzen). Anders ausgedrückt: Die Merkmale sind gewöhnlich so unter den Arten verteilt, daß verschiedene – durchaus gewichtige – Merkmale oder Merkmalskomplexe unterschiedliche Baumdiagramme unterstützen. Evolutionstheoretisch geht man in diesen Fällen davon aus, daß die betreffenden baugleichen Merkmale zwei- oder mehrfach unabhängig entstanden sind, und bezeichnet sie als Konvergenzen*. Da eine mehrmalige unabhängige Entstehung komplexer Merkmale evolutionstheoretisch als eher unwahrscheinlich angesehen wird, versucht man, die Annahme von Konvergenzen zu vermeiden. Da dies nicht generell möglich ist, wählt man den „sparsamsten Baum“, d. h. diejenige Baumdarstellung, in welcher die geringste Anzahl von Konvergenzen postuliert werden muß.
Unter Konvergenzen sollen hier nur solche Ähnlichkeiten verstanden werden, die aufgrund ihres Baus bzw. ihrer Lage im Gesamtgefüge des Organismus so ähnlich sind, daß sie nach den üblichen biologischen Kriterien als homolog gewertet werden. Tab. 1 verdeutlicht diesen Sachverhalt. Nicht gemeint sind Fälle wie z. B. die Konvergenz zwischen Vogelflügel und Insektenflügel als Tragflächen, da ein völlig verschiedener Bau verwirklicht ist. (Auf diese Problematik geht JUNKER [2002] ausführlich ein).
|
| Merkmale |
Taxa |
|
Spinnentiere |
Antennata |
Krebstiere |
| Malpighische Gefäße |
+ |
+ |
- |
| Mandibeln |
- |
+ |
+ |
|
| Merkmale |
Taxa |
|
Weichtiere |
Ringelwürmer |
Gliederfüsser |
| Trochophora-Larve |
+ |
+ |
- |
| mesodermale Segmentation |
- |
+ |
+ |
| Hämocynanin-Atmungspigmente u.a |
+ |
- |
+ |
|
|
|
Tab 1:
Oben: Merkmalsverteilung der Malpighistischen Gefäße (Verdauungsorgane) und Mandibeln (Kawuapparate) für Taxa der Gliederfüßer (nach SUDHAUS REHFELD 1992). Diese Autoren schreiben dazu: "Wir sind gehalten, eine konvergente Entwicklung entweder von Mandibeln oder von Malpighischen Gefäßen kann als gleichwertig eingestuft werden." Zwar könne eventuell der unterschiedliche ontogenetische Bildungsweg als Hinweis darauf gewertet werden, daß die Malpighischen Gefäße konvergent entstanden sind, doch müsse bedacht werden, daß Entwicklungswege homologer Strukturen unterschiedlich sein können. Die Entscheidung darüber, welche Gemeinsamkeit als Indiz für Phylogenetische Verwandschaft zu werten ist, wird mit dem Sparsamkeitskriterium begründet: "Eine klare Entscheidung ist erst möglich, wenn weitere Merkmale in den Vergleich einbezogen werden" (SUHAUS & REHFELD 1992, 88).
Unten: Ein ähnlicher Fall von Merkmalswidersprüchen komplexer Merkmale bei Weichtieren, Ringelwürmern und Gliederfüßern. (Nach EERNISSE et al. 1992) |
Die Merkmale der Lebewesen sind also häufig in einer Art und Weise verteilt, daß Stammbaumrekonstruktionen nicht ohne eine mehr oder weniger große Anzahl von Konvergenzen auskommen. Dabei handelt es sich nicht um seltene Ausnahmen, sondern um die Regel. In manchen Fällen nimmt nun das Vorkommen von Konvergenzen ein solches Ausmaß an, daß die Systematiker zur Darstellung oder Beschreibung der Ähnlichkeitsbeziehung das Baumschema verlassen. Einige Beispiele seien im folgenden angeführt.
So stellt der Botaniker CRONQUIST (1987, 24) fest, daß die Angiospermen (bedecktsamige Blütenpflanzen) mit Konvergenzen durchsetzt sind. MEYEN (1987, 97f.) schreibt in seinem paläobotanischen Lehrbuch, die Merkmalsverteilungen der Farnartigen seien so chaotisch (d. h. treten in so viel unterschiedlichen Merkmalskombinationen auf), daß eine Systematik äußerst erschwert sei. Über Verwandtschaftsverhältnisse bei Farnen gibt es entsprechend „dramatisch verschiedene Hypothesen“ (ROTHWELL 1999, 190). Eine ähnliche Situation zeigt sich bei den devonischen Landpflanzen (JUNKER 1996; s. beispielhaft Abb. 2), aber auch sonst in der Paläobotanik (vgl. z. B. ROTHWELL & SERBET 1994).
 |
| Abb. 2: Netzartige Beziehungen unterdevonischer Pflanzengattungen. (Nach Junker 1996) |
|
Auch im Tierreich gibt es ähnliche Fälle. Die fossil bekannten Reptilgruppen des Karbons können auf der Basis abgeleiteter Merkmale nicht in Form ineinandergeschachtelter Gabelungen phylogenetisch angeordnet werden, es sei denn, es wird eine große Anzahl von Rückwärtsentwicklungen angenommen. Viele Merkmale müssen konvergent entstanden sein (CARROLL 1982, 102f.; CLACK 2002).
FEDUCCIAs (1996) Ausführungen zur Phylogenese der Vögel zeigt, daß Konvergenzen so verbreitet sind, daß der Bau der Vögel nicht verwendet werden kann, um die Phylogenese nachzuzeichnen. Das heißt aber nichts anderes, als daß eine Baumdarstellung mit großen Schwierigkeiten verbunden ist.
MOORE & WILLMER (1997) zeigen in einer Überblicksarbeit auf, daß auch bei den Wirbellosen Konvergenzen weit verbreitet sind und daß das Ausmaß an Konvergenzen stark unterschätzt worden ist. Beispielsweise muß angenommen werden, daß die Tracheen (von außen in den Körper sich verzweigende Luftröhren zur Atmung) mindestens viermal unabhängig entstanden sind, wobei in den betroffenen Tieren das Tracheensystem in fast identischer Weise gebaut ist (MOORE & WILLMER 1997, 14). Bei den Wirbellosen beschränken sich Konvergenzen zudem nicht vornehmlich auf „untergeordnete Merkmale“; sogar komplexe „Design-Merkmale“ seien oft konvergent und für die Rekonstruktion der Phylogenese irreführend (MOORE & WILLMER 1997, 16). Diese beiden Autorinnen kommen zum Schluß, daß jedes phylogenetische Schema der Metazoen auf der Wahl bestimmter Merkmale beruht, und daß stillschweigend davon ausgegangen wird, daß die anderen Merkmale konvergent sein müssen. Bei den Wirbellosen gebe es eine enorme Vielfalt überlappender Merkmalskonstellationen, die in keiner denkbaren Klassifikation in Kongruenz gebracht werden können. Die Schlußfolgerung sei unvermeidlich, daß Konvergenzen „sehr weit verbreitet“ seien (MOORE & WILLMER 1997, 3).
Darüber hinaus glauben MOORE & WILLMER (1997, 3) eine Tendenz unter den Biologen zu erkennen, die Konvergenzproblematik herunterzuspielen oder zu übergehen (vgl. auch PATTERSON 1988, 77). Nach Meinung von ARMBRUSTER (1996, 227) neigen die Systematiker dazu, Merkmale selektiv zu verwenden: „gute“ Merkmale würden bevorzugt, d. h. solche, die wenig Konvergenzen aufweisen. Dies führe zu einer Unterschätzung des Ausmaßes an Konvergenzen.
Baukastensystem? Vor diesem Hintergrund kann es nicht überraschen, daß unter evolutionstheoretischen Voraussetzungen arbeitende und denkende Wissenschaftler immer wieder zu Erkenntnissen gelangen, die die Vorstellung von einem Baukastensystem des Lebens stützen. Nachfolgend zwei Beispiele (weitere finden sich in JUNKER 2002, Kapitel 5):
In ihrem paläobotanischen Lehrbuch schreiben STEWART & ROTHWELL (1993, 212; ähnlich wie der oben zitierte Lehrbuchautor MEYEN), daß es kein einziges Merkmal gebe, wonach eine Pflanze als Farn definierbar ist. Dahinter verbirgt sich nichts anderes als eine baukastenartige Verteilung der Merkmale in den verschiedenen Familien. In phylogenetischen Schemata äußert sich dies in Mehr- oder Vielfachgabelungen (kammartige Form von Teilen von Dendrogrammen in „strict consensus trees“), da sich die Merkmalswidersprüche nicht auflösen lassen.
Ähnliches schildern KNOLL et al. (1984, 41) bei den Angiospermen: Kein Taxon enthalte ausschließlich undifferenzierte oder hochdifferenzierte Merkmale. Die meisten Angiospermen-Familien seien eine Mischung aus mehr oder weniger differenzierten Merkmalen in unterschiedlichen Kombinationen und es gebe keine Familie mit ausschließlich primitiven oder ausschließlich abgeleiteten Merkmalen. Dies gelte auch für den Fossilbericht.
Im Sinne eines „Baukastensystems“ läßt sich auch das Phänomen der „polythetischen Gruppen“ deuten, das besonders bei Pflanzen verbreitet ist. Darunter versteht man Taxa höherer Ordnung, die schwer definierbar sind und sich dadurch „auszeichnen“, daß kein Merkmal, welches in dieser Gruppe vorkommt, bei allen Mitgliedern anzutreffen ist. Alle diese Merkmale sind jedoch in der Gruppe als ganze verbreitet und sie kommen bei den meisten Mitgliedern vor (STEVENS 1984, 171). STEVENS (1984, 172) nennt als Beispiel die Angiospermenfamilie der Doldenblütler (Apiaceae). Alle Merkmale, welche die Doldenblütler charakterisieren, kommen entweder nicht bei allen Arten dieser Familie vor oder sie kommen auch bei anderen Familien vor.
ROTH (1994, 304) macht darauf aufmerksam, daß bis zum frühen 19. Jahrhundert „Geflechte, Netze und Karten“ in der botanischen Systematik verwendet wurden. Unsere gegenwärtige Präferenz für eine verschachtelte Hierarchie folge nicht aus einer der Natur innewohnenden Logik, sondern aus der Entsprechung mit einem Aufzweigungs- und Veränderungsprozeß. Doch der Phylogenetiker könne nicht zur Netzdarstellung zurückkehren, da eine Art oder Gattung nicht in allen Richtungen mit anderen verbunden werden könne. Das gilt erst recht für höhere taxonomische Gruppen, um die es in diesem Beitrag geht. Angesichts der geschilderten Befunde darf bezweifelt werden, daß die Baumdarstellung zurecht als einzige akzeptable Form der systematischen Darstellung gelten kann. Die genannten generalisierenden Feststellungen und die ihnen zugrundeliegenden Befunde entsprechen keineswegs den Erwartungen im Rahmen der Evolutionslehre.
|
|
Lösungsversuche
Konvergenzen aufgrund von Umwelteinflüssen? Die Standarderklärung für das Auftreten von Konvergenzen lautet, es handle sich hierbei um speziellere Umweltanpassungen, die phylogenetisch nicht aussagekräftig seien. Starke Selektionsdrücke unter ähnlichen Umwelteinflüssen sollen unabhängig zu ähnlichen Strukturen geführt haben. Allerdings sind die Merkmale, anhand derer Familien und Ordnungen von Angiospermen unterschieden werden, zum großen Teil solche, die schwerlich mit Anpassung und Überlebensvorteil in Verbindung zu bringen sind (CRONQUIST 1969, 186): die Position des Fruchtknotens, die Form der Kronblätter, die Ausprägung von Früchten, die Stellung der Samenanlage im Fruchtknoten, die Anzahl der Blütenteile, Anwesenheit oder Abwesenheit von Endosperm oder Perisperm im Samen; die Abfolge der Entwicklung der Staubblätter und so weiter. Überall gibt es Konvergenzen, ohne daß ein Zusammenhang mit Umweltanpassungen erkennbar ist (MINELLI 1993, 18).
Auch TROLL, wie CRONQUIST eine Kapazität unter den Botanikern des 20. Jahrhunderts, kommt zu einem ähnlichen Gesamteindruck: „Auch die Konvergenzen erschöpfen sich nicht in solchen Anpassungsmerkmalen. Die pflanzlichen Gestaltungsverhältnisse weisen vielmehr auch in diesen höchst merkwürdigen Erscheinungen unverkennbare Züge nicht adaptiver Natur auf und es sind gerade diese, welche sich an Formen verschiedener Organisation wiederholen. Wir stehen also vor der Tatsache, daß die als Konvergenzen bezeichneten Ähnlichkeiten nicht von außen bedingt und deshalb auch nicht aus konvergenter Anpassung zu erklären sind“ (TROLL 1937, 43; Hervorhebung im Original). Die Mannigfaltigkeit der Organbildung sei größer als die Mannigfaltigkeit der Lebensbedingungen und Funktionsprinzipien.
Lösung durch Molekularbiologie? Molekularbiologische Studien (z. B. basierend auf Sequenzdaten von Proteinen oder DNA) könnten hier weiterhelfen und Kriterien zur Unterscheidung von morphologischen Homologien und Konvergenzen bieten. Konvergenzen wurden jedoch auch bei Protein- oder Nukleotidsequenzen festgestellt (HILLIS 1994, 351; BOLKER & RAFF 1996, 491; RIEPPEL 1988, 62f.). HILLIS rechnet damit, daß weitere Fälle molekularer Konvergenz bekannt werden, wenn sich die Molekularbiologen mit diesem Phänomen befassen werden. Dieses Feld bedarf weiterer Bearbeitung, die den Rahmen dieses Beitrags sprengen würde.
„Superorganismen“ am Anfang? Die Annahme von Konvergenzen könnte vermieden werden, wenn man an den Anfang der Entwicklung Organismen stellen würde, die bereits ein großes Repertoire an Gestaltungsmöglichkeiten besaßen, eine Art „Vorrat“ an Merkmalen bzw. Merkmalsausprägungen. Durch Verluste einzelner Merkmale in verschiedenen evolutionären Linien könnten inkongruente Verteilungen der Merkmale zustandekommen (s. o.). Ein Beispiel soll dies verdeutlichen. Es hat sich zunehmend herausgestellt, daß es Gründe gibt, die Arthropoden (Gliederfüßer) trotz ihrer Gemeinsamkeiten als polyphyletisch zu betrachten (Zusammenfassung in BUDD 1996). Der Grund dafür sind zahlreiche Konvergenzen, die unterschiedliche, sich widersprechende Verwandtschaftsverhältnisse nahelegen (vgl. EERNISSE et al. 1992). Abb. 3 zeigt dies eindrucksvoll: eine Netzdarstellung entspricht offenbar der Formenvielfalt besser als eine Baumdarstellung. Es zeichnet sich ab, daß hinter der verwirrenden Vielfalt eine begrenzte Zahl genetischer Mechanismen stehen könnte. BUDD (1996) spricht von einer genetischen „Toolbox“, deren Einfluß in verschiedenen Entwicklungslinien zur Ausprägung gleicher Phänotypen geführt haben könne. Solche Mechanismen könnten helfen, die zahlreichen Konvergenzerscheinungen bei Arthropoden besser zu verstehen. ADLER (1997, 42f.) kommentiert diese Entwicklung wie folgt: „Das von BUDD angesprochene genetische Instrumentarium der Morphogenese beinhaltet nach derzeitigem Kenntnisstand ein hierarchisches System von Kontrollgenen, über das je nach Organismus und Organ aus einer Grundausstattung morphogenetischer Möglichkeiten die jeweils 'passende' realisiert wird. Dabei ist die Grundausstattung innerhalb größerer systematischer Gruppen wenig verschieden, und die Gestaltunterschiede der Untergruppen und Arten resultieren sozusagen aus der unterschiedlichen Benutzung desselben Baukastens. Vor diesem Hintergrund kann etwa in einem gedachten Ur-Arthropoden ein beachtliches Arsenal an Gestaltmöglichkeiten gedacht werden, das vornehmlich durch Variation der Kontrollinstanz zu der vorliegenden Formenfülle geführt haben könnte.“3 Ein solcher „Super-Arthropode“ am Anfang der Arthopodenevolution stellt bisherige Vorstellungen über evolutionäre Abfolgen im Grunde auf den Kopf. Das Baumschema zur Darstellung der Verwandtschaftsbeziehungen könnte nur in dem Sinne aufrechterhalten werden, daß an seiner Basis eine vielseitige Ausgangsform stand, deren Ausprägungsmöglichkeiten in den Ästen und in verschiedenen Weisen mehr oder weniger verlorengegangen ist.4
 |
| Abb. 3: Ähnlichkeitsbeziehungen unter Lebewesen können als Netzwerk dargestellt werden, hier am Beispiel der Verwandtschaftsverhältnisse der Arthropoden (Gliederfüßer). Je nach zugrundegelegten Merkmalen (verschiedene Untersuchungen) ergeben sich unterschiedliche Gruppierungen. Die entsprechenden Untersuchungen stammen alle aus den 1990er Jahren. (Nach Wägele 2001) |
|
Daß der Mosaikcharakter vieler Fossilien eine Widerspiegelung ähnlicher regulatorischer Gene sein könnte, meint auch SHUBIN (1998). Reguliert werden kann aber nur das, was schon da ist. Soll man also annehmen, daß die in den Fossilien zum Vorschein kommende Vielfalt in einem hypothetischen Vorläufer „gesammelt“ bereits vorlag? Im Grunde genommen nähert man sich mit solchen Überlegungen ideellen Bauplänen, die als „Baukästen“ für unterschiedliche Kombinationen dienen.5
Ein weiteres extremes Beispiel sei noch angeführt: WILLMER (1990) präsentiert einen Wirbellosen-Stammbaum, der fast keine „Baumstrukturen“ mehr besitzt (Abb. 4). Diese Darstellung ergibt sich nach Berücksichtigung praktisch aller Strukturen, die je als Argumente in der hundertjährigen Diskussion ins Feld geführt wurden. Der Stammbaum stellt sich als Wiese dar, die auf den Plathelminthen stockt (WILLMER 1990, 361). GRASSHOFF (1994, 203) bemerkt dazu: „Es ist in diesem Zusammenhang daran zu erinnern, daß zum Beispiel unter den Coelenteraten [= Hohltiere] schon alle Haupt-Gruppen als Ausgangs- und Endformen der Entwicklung requiriert wurden, daß für die vielfältigen Konstruktionen der Schwämme überhaupt keine Entwicklungs-linien auszumachen sind, daß für die Arthropoden [Gliederfüßer] monophyletische, diphyletische oder polyphyletische Entwicklungen behauptet werden ..., daß schließlich Konstruktionstypen vor allem wurmförmiger Tiere, wie z. B. Pogonophoren, Nemertini, oder auch Bryozoen und Brachiopoden als eine Art erratischer Blöcke je nach Strömungsrichtung der Ansichten auf verschiedene Plätze verschoben werden.“ Es ist keine Frage, daß eine solche Situation evolutionstheoretisch unerwartet ist.
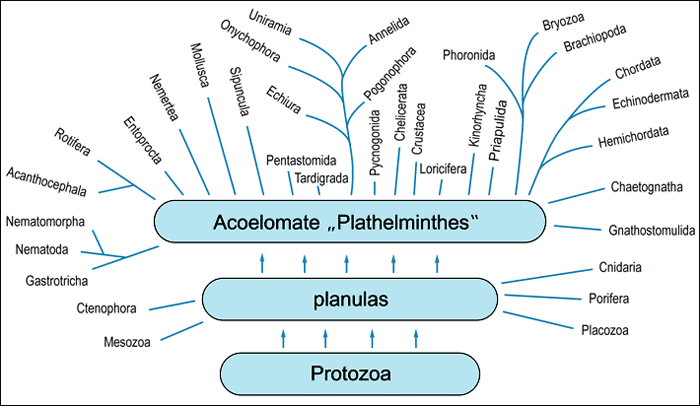 |
| Abb. 4: Verwandtschaftsbeziehungen unter Wirbellosen nach Willmer (1990). |
|
Konvergenzen als „tiefe Homologien“? MEYER (1999) stellt sich vor, daß Konvergenzen dadurch zustande kommen, daß latente Gene und Entwicklungsmechanismen während der Evolution neu „auferweckt“ werden. In Wirklichkeit sollen demnach auch bei Konvergenzen Homologien auf einer tieferen Ebene vorliegen. Durch das längere Ausschalten und spätere Wieder-Einschalten erscheinen dann solche Strukturen als konvergent, die es gar nicht sind. Als Belege für diese Vorstellung bringt MEYER Beobachtungen an Cichliden in den großen ostafrikanischen Seen. Bestimmte markante Körperformen treten offenkundig konvergent auf. Dasselbe gilt für die Ausbildung eines Schwertchens in der Schwanzflosse von Schwertträger-Fischen (Xiphoporini, Abb. 5).
Dieses Konzept läuft auf polyvalente Stammformen hinaus, denn damit Gene oder Entwicklungsmechanismen aufgeweckt werden können, müssen sie schon da sein. Bei MEYERs Beispiel der Cichliden handelt es sich allerdings um mikroevolutive Phänomene, um Vorgänge, die sich innerhalb von Grundtypen (SCHERER 1993) abspielen. Es läßt sich im Sinne polyvalenter Stammformen deuten (FEHRER 1997). Ein erst jüngst veröffentlichtes Beispiel dieser Art ist das Wiedererscheinen von Flügeln bei zuvor flügellos gewordenen Insekten (WHITING et al. 2003).
 |
| Abb. 5: Dendrogramm von Schwertträger-Fischen nach DNA-Sequenzen (X. = Xiphophorus). Rechts ist die Ausbildung der Schwanzflosse mit dem Schwertchen dargestellt. Die unsystematische Verteilung des Schwertchens legt nach Meyer (1997) nahe, daß dieses Merkmal in einer polyvalenten Stammform bereits vorhanden war und mehrfach verlorengegangen ist. (Nach Meyer 1997) |
|
Einer Ausweitung dieses Arguments auf makroevolutive Bereiche, um die es bei den anderen oben genannten Beispielen geht, und die damit verbundenen Zeiträume steht zweierlei entgegen: Zum einen würde ein längeres Stillegen zu irreversib-len Verlusten führen, da den zwangsläufig auftretenden Verlustmutationen selektiv nicht entgegengewirkt werden kann. Zum anderen würde die Ausweitung des Arguments auf einen „Alleskönner“-Organismus am Anfang hinauslaufen, dessen Existenz biologisch vollkommen unplausibel wäre (vgl. die Ausführungen weiter oben über den hypothetischen „Super-Arthropoden“). Das Konzept komplexer Stammformen läuft bei Extrapolation in die Vergangenheit darauf hinaus, die unabhängige Entstehung diskreter Grundtypen zu postulieren, was einem Schöpfungsverständnis entspricht.
|
|
Vorhersagen und Plastizität der Evolutionslehre
Im letzten Abschnitt kamen Befunde zur Sprache, die evolutionstheoretisch unerwartet waren. Man könnte auch sagen, daß aus der Evolutionslehre abgeleitete Schlußfolgerungen in erheblichem Maße widerlegt wurden. Was geschieht nun mit der Evolutionslehre? Sie wird damit keineswegs als widerlegt, nicht einmal als unplausibel betrachtet. Vielmehr kommt hier die Plastizität der Evolutionslehre bzw. aller Ursprungsvorstellungen ins Spiel. Ursprungstheorien sind nur in begrenztem Maße testbar und sie operieren notgedrungen mit vielen Unbekannten. Ein Scheitern bisheriger Vorstellungen führt zu Mutmaßungen, was in den unbekannten „Bereichen“ geschehen sein könnte.
REMINE (1993) meint in diesem Zusammenhang: Würde es beispielsweise nicht gelingen, die Vielfalt der Formen in ein hierarchisch geordnetes System zu bringen, so würden neue Evolutionsmechanismen postuliert werden, etwa horizontaler Gentransfer. REMINE hatte recht: Angesichts der Merkmalsmosaike bei Archaebakterien, Eubakterien und Eukaryonten wird mittlerweile genau dies diskutiert und ausdrücklich angenommen (DOOLITTLE 2000; vgl. NEUHAUS 2000).
Evolutionstheoretisch könne – so REMINE – ein hierarchisches Ordnungssystem zwar grundsätzlich erwartet werden; andere Erwartungen sind aber auch möglich:
- Werden fließende Übergänge von Art zu Art zugrundegelegt, könnte auch das Fehlen klarer Grenzen erwartet werden.
- Sterben zu viele Arten unentdeckt aus, könnte ein chaotisches Muster verschiedener Merkmale übrigbleiben.
Der Befund überraschend vieler Konvergenzen führt zum Postulat „tiefer“ Homologien (s. o.) oder genetisch extrem vielseitig ausgestatteter Stammformen, deren Existenz jedoch vorerst hypothetisch ist.
Widersprechende oder problematische Befunde verlieren durch neue Anpassungen der Evolutionstheorie ihre falsifizierende Kraft.6 Man kann hier wohl mit Fug und Recht die Frage stellen, wie eine evolutionär orientierte Systematik im Bereich der Vergleichenden Biologie widerlegt werden könnte. Denn offenkundig kann die Evolutionslehre an recht unterschiedliche Ähnlichkeitsmuster angepaßt werden.
|
|
Vorhersagen und Prüfbarkeit der Schöpfungslehre?
Eingangs wurde geschildert, weshalb Schöpfungs-Alternativen zur Evolutionslehre von den meisten Biologen schon im „Vorfeld“ (aus wissenschaftstheoretischen Gründen) nicht in Betracht gezogen werden, wenn es um die Deutung des Ähnlichkeitsmusters der Lebewesen geht. Ein Hauptargument lautete, im Rahmen von Schöpfungsvorstellungen könnten beliebige Muster oder auch die Abwesenheit irgendeines Musters vorhergesagt werden. Daher könne also alles und folglich nichts erklärt werden. Nun hat sich aber herausgestellt, daß sich die Evolutionslehre in einer ähnlichen Situation befindet. Offenbar ist es in keinem Ursprungsmodell möglich, bestimmte zu erwartende Ähnlichkeitsmuster zwingend vorherzusagen. Vielmehr kann es nur darum gehen, Plausibilitätsbetrachtungen im nachhinein anzustellen.
Der typologische Einstieg. Wie auch immer in der Systematik vorgegangen wird – es ist immer ein typologischer Einstieg notwendig: Die Formenvielfalt muß bestmöglich erfaßt werden (TOMLINSON 1984, 380; vgl. BRADY 1985). RIEPPEL (1989) weist darauf hin, daß die Systematik – historisch belegt – von der Evolutionslehre unabhängig ist. „Arten müssen erst als solche erkannt sein, bevor sie aufgrund eines kontinuierlichen Abstammungsprozesses miteinander verknüpft werden können. Die systematische Forschung geht mit logischer Notwendigkeit einer Erklärung der Ordnung in der Natur durch die Hypothese von 'descent with modification' voraus“ (RIEPPEL 1989, 197; Hervorhebung im Original). NELSON & PLATNICK (1981, 328) sind der Auffassung: „... systematists always have been, are, will be, and should be, typologists.“ Die Merkmalsanalyse und die Ermittlung von Ähnlichkeiten ist also relativ theorieneutral; das gilt auch für die Cladistik, deren Prozedere zwar ausdrücklich evolutionstheoretisch motiviert ist, aber unabhängig von ihr durchgeführt werden kann (RIDLEY 1983, 651).
Wie könnte man nun im Rahmen von Schöpfungsanschauungen konkret vorgehen? Die Ermittlung von Ähnlichkeitsmustern kann nach bewährten, möglichst theorieneutralen Verfahren vorgenommen werden. Weist das Muster der Ähnlichkeiten der Lebewesen Indizien auf, die Hinweise auf eine unabhängige Entstehung der Grundtypen abgeben? Welche prüfbaren Vorhersagen an das zu erwartende Daten-muster können formuliert werden?
Man könnte nun folgenden Ansatz verfolgen. Es wird postuliert, daß die Lebewesen nach einem hierarchischen Ordnungsschema und nach einem Baukastenprinzip geschaffen wurden, d. h.: Merkmale können grundsätzlich frei kombiniert gedacht werden. Dies äußert sich in Konvergenzen. Zuviele Konvergenzen würden allerdings eine Ordnungsmöglichkeit erschweren oder sogar unmöglich machen.
Wenn man eine Gruppe von Lebewesen, deren Ähnlichkeitsmuster zahlreiche Konvergenzen aufweist, aufgrund des Besitzes gemeinsamer Merkmale miteinander verbindet, so entsteht ein Netzwerk von Beziehungen (vgl. Abb. 2 und 3).
Vor diesem Hintergrund kann man nun die Vorhersage treffen, daß weitere Funde heutiger oder fossiler Arten bzw. neue Erkenntnisse über die Ähnlichkeit der Lebewesen eher zu neuen Vernetzungen führen als bisherige Stammbaumrekonstruktionen stützen werden. Es sei ausdrücklich hervorgehoben, daß es sich dabei um eine konkrete, prüfbare Vorhersage handelt.
Die oben erwähnte Tatsache, daß zahlreiche Konvergenzen nicht-adaptiver Natur sind, findet in diesem Konzept eine schlüssige Deutung. Man kann hier die Vermutung anstellen, daß sich in solchen Merkmalen Konstanten verschiedener Grundtypen zeigen, die auch hier häufig mosaikartig verteilt sind.
|
|
Dank
Mein herzlicher Dank gilt Dr. Judith FEHRER, Dr. Klaus NEUHAUS, Prof. Dr. Siegfried SCHERER und Dr. Henrik ULLRICH für zahlreiche wertvolle Hinweise zur Verbesserung des Textes.
|
Anmerkungen
1. Ob es überhaupt Ordnung in der Natur gibt, die objektiv vorgegeben ist (sei es durch einen Evolutionsablauf oder durch ein Wirken eines Schöpfers) und vom forschenden Menschen nachgezeichnet werden kann, soll hier nicht diskutiert werden. ROSSMANN (2000) charakterisiert diese Auffassung als „naturalistische“ Einstellung, der er die „handlungstheoretische“ Einstellung gegenüberstellt, wonach sich der Naturforscher bewußt ist, daß er in die Natur eingreift und selbst Teil des Forschungsgegenstandes ist; natürliche Kategorien würden demnach erzeugt, Ordnung wäre ein Produkt des menschlichen Geistes, das nicht primär in der Natur vorgegeben wäre. Stillschweigend wird wohl von den meisten Biologen eine naturalistische Vorstellung vorausgesetzt. ROSSMANN vertritt die These, daß die Taxonomie, Systematik und ihre phylogenetischen Schlußfolgerungen vom Standpunkt und den Definitionen des Bearbeiters abhängen. Daraus folgt für ihn ein „biologisches Unschärfeprinzip“, was aus der Unfähigkeit des Naturforschers resultiert, die Natur objektiv wahrzunehmen und zu beschreiben, da er selbst als Teil der Natur Einfluß auf sie ausübt.
2. Das Baumschema zur Darstellung systematischer Zusammenhänge wurde bereits Ende des 18. Jahrhunderts im Rahmen der Stufenleiterlehre genutzt und durch die Arbeiten HAECKELs in die Phylogenetik übernommen.
3. Sollte sich die Vorstellung eines umfassenden genetischen „Grundbaukastens“ festigen, so müßten die Begriffe der Cladistik und die darauf beruhenden Systeme auf ihre Schlüssigkeit angesichts der genetischen Gegebenheiten überprüft werden (vgl. ADLER 1997).
4. ADLER (1997) weist darauf hin, daß sich aufgrund solcher Befunde ein grundlegender Wandel in phylogenetischen Rekonstruktionen einstellen könnte. SHUBIN (1998) fragt: „Wenn unabhängige Evolution von Schlüsselmerkmalen verbreitet ist, wie soll Phylogenese dann rekonstruiert werden?“ Die Orientierung an gemeinsamen abgeleiteten Merkmalen (Synapomorphien) könnte in die Irre führen.
5. Damit kommt man wieder der ursprünglichen, im Rahmen der Präformationslehre genutzten Bedeutung des Wortes Evolution sehr nahe: Entwicklung als „Auswicklung“ bereits vorhandener Merkmale.
6. Gemeint ist damit, daß zwar bestimmte Hypothesen über evolutionäre Abläufe falsifiziert werden können, nicht aber der generell zugrundeliegende evolutionstheoretische Rahmen.
|
Glossar
- Cladistik:
- Methode, die auf der Basis einer Merkmals-analyse und einer Wertung der Merkmale als „ursprünglich“ und „abgeleitet“ die stammesgeschicht-lichen Positionen der untersuchten Taxa bestimmen will. (Zur Vorgehensweise der Cladistik und zum Unterschied zur Phänetik wird auf die einschlägige Literatur verwiesen, z. B. RIDLEY 1991.)
- Homologie:
- hier: Gleichwertigkeit von Strukturen oder Organen im Bau und in der Lage im Gesamtorganismus, unabhängig von deren Funktion.
- Konvergenz:
- mehrfach unabhängig (von verschiedenen Ausgangsstrukturen) entstandenes baugleiches Merkmal.
- Phänetik:
- Taxonomische Vorgehensweise, bei der das Ausmaß der Ähnlichkeit bzw. Unähnlichkeit zwischen verschiedenen Taxa bestimmt wird, ohne daß die zugrundegelegten Merkmale in „ursprünglich“ und „abgeleitet“ gewichtet werden.
- Systematik:
- Biologische Arbeitsrichtung, die die stammesgeschichtlichen Zusammenhänge der Organismen zu ermitteln versucht.
- Taxonomie:
- Wissenschaft, die sich (unabhängig von eventuell zugrundeliegenden Ursprungskonzepten) mit der Ordnung und Einteilung der Lebewesen befaßt.
|
Literatur
- ADLER M (1997)
- Neues zur Systematik der Arthropoden. Stud. Int. J. 4, 41-43.
- ARMBRUSTER WS (1996)
- Exaptation, adaptation, and homoplasy: Evolution of ecological traits in Dalechampsia vines. In: SANDERSON MJ & HUFFORD L (eds) Homoplasy: The recurrence of similarity in evolution. San Diego, pp 227-243.
- BOLKER JA & RAFF RA (1996)
- Developmental genetics and traditional homology. BioEssays 18, 489-494.
- BRADY RH (1985)
- On the independence of systematics. Cladistics 1, 113-126.
- BROWER AVZ (2000)
- Homology and the inference of systematic relationships: some historical and philosophical perspectives. In: SCOTLAND R & PENNINGTON RT (eds) Homology and systematics. Coding characters for phylogenetic analysis. London, New York, pp 10-21.
- BUDD CE (1996)
- Progress and problems in arthropod phylogeny. Trends Ecol. Evol. 11, 356-358.
- CARROLL RL (1982)
- Early evolution of reptiles. Ann. Rev. Ecol. Syst. 13, 87-109.
- CLACK JA (2002)
- Gaining ground. The origin and evolution of tetrapods. Bloomington and Indianapolis.
- CRONQUIST A (1969)
- On the relationship between taxonomy and evolution. Taxon 18 177-187.
- CRONQUIST A (1987)
- A botanical critique of cladism. Bot. Rev. 53, 1-52.
- DARWIN C (1859)
- The origin of species by means of natural selection or the preservation of favoured races in the struggle for life. Nachdruck der 1. Auflage. Penguin Books, Harmondsworth, Middlesex, England, 1968; mit einer Einführung von J. W. BURROW. Dt.: DARWIN C (1967 [1859]) Die Entstehung der Arten durch natürliche Zuchtwahl. Stuttgart.
- DOOLITTLE WF (2000)
- Stammbaum des Lebens. Spektr. Wiss. 4/2000, 52-57.
- EERNISSE DJ, ALBERT J & ANDERSON FE (1992)
- Annelida and Arthropoda are not sister taxa: A phylogenetic analysis of spiralian metazoan morphology. Syst. Biol. 41, 305-330.
- FEDUCCIA A (1996)
- The Origin and Evolution of Birds. Yale.
- FEHRER J (1997)
- Explosive Artbildung bei Buntbarschen in ostafrikanischen Seen. Stud. Int. J. 4, 51-55.
- GRASSHOFF M (1994)
- Konzepte der Morphologie und die Rekonstruktion der Stammesgeschichte. In: GUTMANN WF, MOLLENHAUER D & PETERS DS (Hg) Morphologie und Evolution. Frankfurt, S. 201-220.
- HILLIS DM (1994)
- Homology in molecular biology. In: HALL BK (ed) Homology. The hierarchical basis of comparative biology. San Diego, pp 339-368.
- JUNKER R (1996)
- Evolution früher Landpflanzen. Eine kritische Diskussion fossiler Funde. Studium Integrale. Neuhausen-Stuttgart.
- JUNKER R (2002)
- Ähnlichkeiten, Rudimente, Atavismen. Design-Fehler oder Design-Signale? Holzgerlingen.
- KNOLL AH, NIKLAS KJ, GENSEL PG & TIFFNEY BH (1984)
- Character diversification and patterns of evolution in early vascular plants. Paleobiology 10, 34-47.
- LEE MSY (1999)
- Circularity, evolution, systematics ... and circularity. J. Evol. Biol. 12, 724-734.
- LORENZEN S (1994)
- Phylogenetische Systematik gestern, heute und morgen. Biol. in uns. Zeit 24, 200-206.
- MAHNER M (2002)
- Kreationismus. In: SAUERMOST R & FREUDIG D (Red.) Lexikon der Biologie, Bd. 8. Heidelberg, S. 202-203.
- MEYEN SV (1987)
- Fundamentals of Paleobotany. London, New York.
- MEYER A (1997)
- The evolution of sexually selected traits in male swordtail fishes (Xiphophorus: Poeciliidae). Heredity 79, 329-337.
- MEYER A (1999)
- Homology and homoplasy: the retention of genetic programmes. In: Homology. Novartis Foundation Symposium 222. Chichester, pp 141-157.
- MINELLI A (1993)
- Biological Systematics. The State of the Art. London.
- MOORE J & WILLMER P (1997)
- Convergent evolution in invertebrates. Biol. Rev. 72, 1-60.
- NELSON G & PLATNICK N (1981)
- Systematics and biogeography. Cladistics and vicariance. New York.
- NEUHAUS K (2000)
- Wächst der Stammbaum der Evolution jetzt im Vorgarten der Schöpfungslehre? Stud. Int. J. 7, 88-89.
- PATTERSON C (1988)
- The impact of evolutionary theories on systematics. In: HAWKSWORTH DL (ed) Prospects in systematics. Oxford, pp 59-91.
- PETERS DS & GUTMANN WF (1971)
- Über die Lesrichtung von Merkmals- und Konstruktions-Reihen. Z. zool. Syst. Evolut.-forsch. 9, 237-263.
- REMINE WJ (1993)
- The Biotic Message. Evolution versus Message Theory. Saint Paul, Minnesota.
- RIDLEY M (1991)
- Evolution. 2nd ed. Cambridge, Mass.
- RIEPPEL O (1988)
- Fundamentals of comparative biology. Basel.
- RIEPPEL O (1989)
- Über die Beziehung zwischen Systematik und Evolution. Z. zool. Evolut.-forsch. 27, 193-199.
- RIEPPEL O (1993)
- The conceptual relationship of ontogeny, phylogeny, and classification. The taxic approach. In: HECHT MK et al. (eds) Evolutionary biology, vol. 27. New York, pp 1-32.
- ROSSMANN T (2000)
- Grundprobleme der Taxonomie, Systematik und Phylogenie – aus der Sicht eines paläontologisch arbeitenden Biologen. Stud. Int. J. 7, 59-67.
- ROTH VL (1994)
- Within and between organisms: Replicators, lineages, and homologies. In: HALL BK (ed) Homology: The hierarchical basis of comparative biology. San Diego, pp 301-337.
- ROTHWELL GW (1999)
- Fossils and ferns in the resolution of land plant phylogeny. Bot. Rev. 65, 188-218.
- ROTHWELL GW & SERBET R (1994)
- Lignophyte phylogeny and the evolution of Spermatophytes: a numerical cladistic analysis. Syst. Bot. 19, 443-482.
- SCHERER S (1993)
- Basic types of life. In: SCHERER S (Hg) Typen des Lebens. Berlin, pp 11-30.
- SHUBIN N (1998)
- Evolutionary cut and paste. Nature 394, 12-13.
- STEVENS PF (1984)
- Metaphors and typology in the development of botanical systematics 1690-1960, or the art of putting new wine in old bottles. Taxon 33, 169-211.
- STEWART WN & ROTHWELL GW (1993)
- Paleobotany and the evolution of plants. Cambridge.
- SUDHAUS W & REHFELD K (1992)
- Einführung in die Phylogenetik und Systematik. Stuttgart, Jena, New York.
- TOMLINSON PB (1984)
- Homology: an empirical view. Syst. Bot. 9, 374-381.
- TROLL W (1937)
- Vergleichende Morphologie der höheren Pflanzen, Erster Band, Erster Teil. Berlin.
- WÄGELE JW (2001)
- Grundlagen der Phylogenetischen Systematik. München (2. Aufl.).
- WHITING MF, BRADLER S & MAXWELL T (2003)
- Loss and recovery of wings in stick insects. Nature 421, 264-267.
- WILLMER P (1990)
- Invertebrate relationships. Pattern in animal evolution. Cambridge.
|
|  |
